I Tumori della Vescica: Carcinoma della vescica non muscolo invasivo
1.Epidemiologia
Il tumore uroteliale della vescica è il tumore maligno più comune del tratto urinario, il settimo più comune tra gli uomini e il diciassettesimo più comune nelle donne. Il tasso di incidenza standardizzato in tutto il mondo è di 9 su 100.000 negli uomini e di 2 su 100.000 nelle le donne (dati del 2008). Il tasso di incidenza del tumore uroteliale è aumentato nel corso degli ultimi 60 - 70 anni, ma tale crescita è recentemente diminuita significativamente e in alcune aree geografiche si è stabilizzata. Purtroppo, il tasso di incidenza è in aumento nei paesi sottosviluppati dove l'industrializzazione degli ultimi anni ha portato all'esposizione di queste popolazioni ai cancerogeni.
Secondo le ultime statistiche dell’ American Cancer Society, ci sono stati 68.810 casi totali diagnosticati negli Stati Uniti nel 2007, composti da 51.230 uomini e 17.580 donne, rappresentando il 7% di tutti i tumori.
Nell'Unione Europea l'incidenza è di 27 su 100.000 negli gli uomini e di 6 su 100.000 nelle donne. l'incidenza di questo tumore varia tra regioni e paesi; in Europa, il più alto tasso di incidenza è stato segnalato in Spagna (41,5 negli uomini e 4,8 nelle donne) e il più basso in Finlandia (18,1 negli uomini e 4,3 nelle donne).
Le variazioni sono in parte causate dalla diversa metodologia e qualità dei dati raccolti, quindi occorre prestare attenzione nell'interpretazione dei risultati.
Il tasso di mortalità in tutto il mondo è di 3 su 100.000 negli uomini contro 1 su 100.000 nelle le donne.
Il carcinoma della vescica è una malattia letale con 14.100 decessi registrati nel 2007 negli Stati Uniti, composti da 9950 uomini e 4150 donne, pari al 3% di tutti i decessi per cancro. È importante sottolineare che sempre negli Stati Uniti, c’è stata una diminuzione del 5% della mortalità per cancro della vescica tra il 1990 e il 2004 nonostante un aumento continuo dell'incidenza.
Nell'Unione Europea, il tasso di mortalità è di 8 su 100.000 negli uomini e 3 su 100.000 nelle donne. Nel 2008, il cancro della vescica era l'ottava causa più comune di mortalità specifica per cancro in Europa.
L'incidenza del cancro della vescica è diminuita nelle statistiche, forse grazie al minor impatto di agenti eziologici, come il fumo e l'esposizione professionale. Anche la mortalità da cancro alla vescica è così diminuita, forse grazie ad un aumento dei livelli di cura.
Il rischio di sviluppare il cancro invasivo della vescica è età dipendente. Per gli uomini dalla nascita ai 39 anni di età, il tasso di incidenza del cancro invasivo della vescica è 0,02%; in età da 40 a 59 anni è 0,41%; in età di 60 ai 69 anni, 0,96%; età 70 anni e più, 3,5%; e dalla nascita alla morte, 3,7%. L'incidenza del cancro alla vescica per le donne dalla nascita all'età 39 anni è dello 0,1%; età da 40 a 59anni, 0,13%; età da 60 a 69 anni, 0,26%; età 70 anni e più, 0,99%; dalla nascita alla morte, 1.17%. In generale, gli adolescenti e i giovani adulti (meno di 40 anni), tendono a sviluppare un tumore della vescica ben differenziato non invasivo, piuttosto che invasivo.
Circa il 75% dei pazienti affetti da cancro alla vescica presentano una malattia confinata alla mucosa (stadio Ta, CIS) o sottomucosa (stadio T1). Queste categorie sono raggruppate come i tumori della vescica non muscolo-invasivi. Il tumore della vescica non-muscolo invasivo (NMIBC) ha un'alta prevalenza a causa di tassi di progressione bassi e in molti casi sopravvivenza a lungo termine; i pazienti con tumore alla vescica muscolo-invasivo (MIBC) invece sono a più alto rischio di mortalità specifica per il cancro.
2. Eziologia
2.1 Genetica
La più alta incidenza di cancro alla vescica nei bianchi rispetto ai maschi afro-americani non è probabilmente genetica, ma ambientale, o può essere correlata alla differente suscettibilità ad agenti cancerogeni.
Ci sono diversi polimorfismi genici che sembrano essere correlati alla formazione di cancro alla vescica, in particolare alla suscettibilità ad agenti cancerogeni ambientali.
N-acetil transferasi (NAT) disintossica nitrosammine, un noto cancerogeno della vescica. In particolare, NAT-2 regola la velocità di acetilazione di composti come la caffeina, che sono connesse con la formazione del cancro della vescica. Il polimorfismo “acetilatore lento” NAT-2 è associato al cancro della vescica con un odds ratio di 1,4 rispetto al “polimorfismo veloce” (Garcia-Closas et al, 2005).
Glutatione-S transferasi (GSTM1) coniuga diverse sostanze chimiche reattive, comprese ammine aromatiche e nitrosamine. Un polimorfismo caratterizzato da una delezione della maggior parte della regione codificante del gene, determina una perdita di funzionalità dell’enzima. Questo polimorfismo è associato ad un rischio relativo di 1.5 (Garcia-Closas et al, 2005).
La suddetta varietà genetica GSTM1 e la variante “acetilatore lento” NAT-2 possono portare ad alti livelli di 3-amminobifenile e quindi a maggior rischio di cancro alla vescica. Questi polimorfismi sono presenti in 27% di bianchi, il 15% degli afro-americani, e il 3% dei maschi asiatici, quindi in parte spiegano la diversa incidenza dei tassi del cancro della vescica tra gruppi etnici.
E' sempre più evidente che la predisposizione genetica ha una notevole influenza sull'incidenza del tumore della vescica specialmente attraverso il suo impatto sulla suscettibilità ad altri fattori di rischio.
2.2 Fattori di rischio esterni
Oltre alla pelle e polmoni, la vescica è il principale organo interno colpito da agenti cancerogeni professionali. I principali colpevoli sono le ammine aromatiche che si legano al DNA (Delclos e Lerner, 2008; Reulen et al, 2008). Dal 20% al 27% di tutti i tumori della vescica risultano associati all'esposizione industriale di un certo tipo, soprattutto in aree con una forte concentrazione di industrie relazionate all’uso di sostanze chimiche (Caso e Hosker, 1954; Blot e Fraumeni, 1978; Reulen et al, 2008). Tra i primi agenti chimici implicati nella formazione del cancro della vescica in lavoratori di gomma e tinture erano benzidina e β-naftilammina (Case e Hosker, 1954).
L'attivazione di queste ammine per consentire il legame del DNA avviene con enzimi che sono selettivamente espressi nella popolazione, rendendo alcuni soggetti più sensibili alla formazione di cancro, come descritto sopra per i NAT-2 e GSTM1 polimorfismi. Ci sono 11 specifiche ammine aromatiche implicati nella formazione del cancro della vescica; essi sono suddivisi in tre gruppi-definiti, probabili, e possibili, come si vede nella Tabella 80-1.
Altri agenti industriali implicati nella formazione del cancro della vescica includono idrocarburi policiclici aromatici(IPA), scarico di motori diesel, e sostanze contenute all’interno di vernici (Zeegers et al, 2001a).
Agenti cancerogeni ambientali possono entrare nell’organismo e provocare il cancro della vescica per inalazione o attraverso assorbimento dalla pelle. In generale, vi è un lungo periodo di latenza di 10 a 20 anni tra l'esposizione industriale e la formazione del cancro alla vescica, così dimostrare le relazioni causali definitive è difficile (Dryson et al, 2008). Tuttavia, ci sono una varietà di occupazioni statisticamente associati alla formazione di cancro alla vescica, e tutti sono di natura industriale(Reulen et al, 2008). L'aumento del rischio complessivo di formazione di cancro della vescica in lavoratori industriali è del 30%, con i lavoratori agricoli aventi il più basso tasso di rischio, mentre i lavoratori della gomma risultano i più esposti e più colpiti dal cancro della vescica.
2.3 Fumo di tabacco (per primo)
Il tabacco è la principale causa conosciuta per la formazione del cancro uroteliale, in particolare il fumo di sigaretta, incide per il 60% e il 30% di tutti i tumori uroteliali nei maschi e nelle femmine, rispettivamente (Brennanet al, 2000, 2001; Boffetta, 2008; Gandini et al, 2008). Il relativo rischio di sviluppare il cancro uroteliale dal fumo è 2.8 e 2.73 negli uomini e nelle donne, rispettivamente (Gandini et al, 2008).
Nel complesso vi è da 2 a 6 volte maggiore probabilità di sviluppare carcinoma uroteliale con il fumo, e l'intensità e la durata del fumo è linearmente correlata alla aumento del rischio, senza alcun livello di plateau chiaro (Brennan et al, 2000; Fumo, 2004; Boffetta, 2008).
Se una persona fuma da 1 a 9 sigarette contro più di 21 sigarette al giorno, il rischio relativo del cancro della vescica è di 1,5 contro 5,4 rispettivamente (Weir e Dunn, 1970). Se una persona fuma da 1 a 10 anni rispetto a più di 40 anni, il rischio relativo di cancro della vescica è di 1,2 contro 3,0, rispettivamente, (Burns e Swanson, 1991). Se una persona fuma per più di 60 anni ha un rischio sei volte maggiore di sviluppare cancro uroteliale rispetto a un non fumatore (Burch et al, 1989). Il tipo di tabacco fumato sembra essere associato alla formazione del cancro della vescica a causa delle diverse sostanze cancerogene presenti al suo interno. Sigari e pipe sono probabilmente associati alla formazione di cancro alla vescica, ma ci sono troppo pochi studi che hanno valutato solo sigari e pipa a causa della elevata probabilità che questi soggetti fumano anche sigarette. Il rischio di formazione del cancro alla vescica in coloro che masticano il tabacco non è chiaro. In generale vi è un aumentato rischio formazione del cancro alla vescica associato con il tabacco da masticare. Il rischio di fumo passivo nella formazione del cancro della vescica è basso e non statisticamente diverso da quello per non fumatori (Zeegers et al, 2002). È importante sottolineare che smettere di fumare ha una differenza nella formazione del cancro uroteliale. I fumatori che hanno smesso da 1 a 3 anni hanno un rischio relativo 2,6, e quelli che hanno smesso per più di 15 anni hanno un rischio relativo di 1.1 (Wynder e Goldsmith, 1977; Fumo, 2004). Il fumo è responsabile del 30% di tutti i decessi per cancro della vescica nei maschi e del 46% di tutti i decessi per cancro della vescica in paesi ad alto reddito e il 28% nei paesi a basso e medio reddito(Brennan et al, 2000; Parkin, 2008). L'impatto del fumo sulla mortalità è più sorprendente nelle donne, in cui il fumo è responsabile del 13% dei decessi per cancro della vescica, con il 29% nei paesi ad alto reddito rispetto al solo 3% nei paesi a basso e medio reddito.
2.4 Fattori nutrizionali
La maggior parte delle sostanze nutritive o di altri metaboliti che vengono escreti nelle urine hanno un prolungato contatto con l'urotelio, in particolare nella vescica; quindi la nutrizione gioca un ruolo importante nella formazione del cancro uroteliale (Steinmaus et al, 2000; Brinkman e Zeegers, 2008).
Tuttavia, ci sono rapporti inconsistenti per quanto riguarda esattamente i frutti e le verdure che hanno benefici nella prevenzione del cancro uroteliale, suggerendo che sono in gioco dei fattori epidemiologici. In generale, un'alimentazione sana e mediterranea porta ad un più basso rischio di cancro uroteliale. In uno studio caso-controllo, ci sono stati meno casi di cancro uroteliale nel gruppo che adotta una dieta mediterranea rispetto a uno standard che adotta una Dieta occidentale, probabilmente a causa della maggiore ingestione di frutta e verdura (de Lorgeril et al, 1998). Entrambi, frutta e verdura, in particolare agrumi, mele, frutti di bosco, pomodori, carote e verdure crocifere, contengono diversi composti attivi che sono importanti nella disintossicazione.
Questi composti comprendono polifenoli, antiossidanti, ed enzimi che modulano la disintossicazione di ammine di azoto e possono prevenire la formazione di addotti del DNA e danni ossidativi (Boffetta, 2008; De Stefani et al, 2008; Lumbreras et al, 2008).
I micronutrienti associati ad un effetto preventivo sulla formazione del cancro uroteliale sono principalmente antiossidanti, tra cui le vitamine A, C, ed E, selenio e zinco (Michaud et al, 2000; Zeegers et al, 2002; Schabath et al, 2005; Brinkman e Zeegers, 2008). Pesce, riso, cereali non sembrano avere un effetto protettivo o dannoso sulla formazione del cancro uroteliale (Radosavljevic et al, 2005).
Gli alimenti che invece hanno un effetto indeterminato sulla formazione di cancro alla vescica includono manzo, uova e carni trasformate (Balbi et al, 2001; Wakai et al, 2004; Brinkman e Zeegers, 2008). Fattori nutrizionali che sono stati associati con causa o favoreggiamento la formazione di tumore uroteliale includono salati e carne alla brace, carne di maiale, grassi totali, sottaceti, soia e spezie (Balbi et al, 2001).
La presenza di tumore uroteliale è moderatamente più elevato in bevitori di caffè e tè, ma questo può essere aggravato dal fumo o da altri fattori dietetici associati con le persone che bevono caffè o tè (Pelucchi et al, 2008). Non vi è nessuna associazione di intensità o durata nell’ ingestione di caffè e tè, che suggerisce un effetto causale indiretto, a differenza di quello che accade per il fumo. Caffè e tè non sembrano avere alcun effetto cancerogeno negli animali; tuttavia, uno studio ha mostrato un aumento di due volte nella formazione del cancro uroteliale nei non fumatori che hanno bevuto grandi quantità di caffè nella parte occidentale di New York (Vena et al, 1993a). In conclusione, vi sono incongruenze per quanto riguarda i fattori nutrizionali legati alla formazione del cancro uroteliale, in parte a causa degli effetti e delle associazioni confondenti, tra cui ingestione di caffè e il fumo, l'ingestione di frutta e verdura, senza il coinvolgimento del fumo, e fattori epidemiologici. Tuttavia, anche se non direttamente causativa, c'è una chiara associazione tra una dieta sana e una diminuzione del rischio di formazione di tumore uroteliale.
2.4 Assunzione di liquidi
la teoria Urogenesis prescrive che diminuendo l'assunzione di liquidi porta a meno minzione e le concentrazioni più elevate di potenziali agenti cancerogeni nelle urine e di conseguenza un aumento del rischio di cancro alla vescica (Braver et al, 1987). Una meta-analisi ha concluso che circa il 50% degli studi hanno mostrato un'associazione sull’assunzione di liquidi e rischio di cancro alla vescica e il 50% non ha trovato un'associazione (Brinkman e Zeegers, 2008). Aggiungendosi alla controversia, Vena e colleghi (1993b) hanno riportato una diminuzione del rischio di cancro alla vescica con una maggiore assunzione di liquidi nelle donne, ma il contrario era vero negli uomini. In conclusione, anche se ha senso affermare che una maggiore assunzione di liquidi farebbe diminuire la concentrazione di potenziali agenti cancerogeni e diminuire il rischio di cancro alla vescica in tal modo, i dati scientifici a sostegno di questa teoria sono inconcludenti.
2.5 Alcool
L'assunzione di alcool è legato a diversi tipi di cancro, compresi quelli della cavità orale, esofago, fegato, laringe e della mammella, pari al 3,6% di tutti i tumori (Boffetta e Hashibe, 2006; Pelucchi et al, 2008). Tuttavia, una meta-analisi della letteratura degli ultimi 20 anni non ha mostrato un'associazione tra assunzione di alcol e cancro della vescica, con un rischio relativo di 1.2-1.3 complessivo negli uomini e 1,0 nelle donne (Zeegers et al, 2001b).
2.6 Dolcificanti artificiali
Alcuni studi sugli animali hanno dimostrato che dosi elevate di saccarina o ciclammati possono influenzare lo sviluppo del tumore della vescica (Allen et al, 1957; Sontag, 1980). Questi studi sono controversi a causa delle alte dosi di saccarina e ciclammati fornite agli animali e la composizione alterata di questi composti, che possono aver influenzato l'attività cancerogena trovata negli studi sugli animali (Cohen et al, 1995). Studi epidemiologici sull'uomo non hanno mostrato alcuna evidenza di un aumentato rischio di cancro alla vescica nei consumatori di dolcificanti artificiali (Armstrong e Doll, 1975; Morrison et al, 1982).
2.7 Abuso di analgesici
Il paracetamolo è il metabolita attivo di fenacetina, un antipiretico e analgesico comunemente usato. Consumi di grandi quantità di paracetamolo o fenacetina (da 5 a 15 kg nel corso di un periodo di 10 anni) sono stati associati ad un aumentato rischio di cancro renale e, forse, il cancro della vescica (Piper et al, 1985).
Tuttavia, Kaye e colleghi (2001) non hanno trovato associazione tra paracetamolo o ingestione di altri farmaci anti-infiammatori non steroidei e cancro della vescica.
2.8 Infiammazioni / Infezioni
L'infezione è chiaramente un contributo alla formazione di carcinoma a cellule squamose in pazienti con infezione cronica da Schistosoma hematobium (Abol-Enein, 2008). Esiste un possibile legame tra il papillomavirus umano (HPV) e la formazione di cancro uroteliale. HPV codifica due oncoproteine, E6 e E7.
E6 interagisce con TP53, che ha un ruolo nella progressione del cancro della vescica e la sua formazione (Westenend et al, 2001). Una meta-analisi supporta una possibile associazione tra infezione da HPV e cancro della vescica, riportando un rischio relativo 2,3, con intervalli di confidenza di 1,3-4,1 (Gutierrez et al, 2006). Il virus BK è oncogeno in criceti neonati e può immortalare cellule di mammifero in vitro (Newton et al, 2005).Il virus BK può causare grave cistite emorragica nei trapiantati di midollo osseo; tuttavia, non vi è alcun nesso coerente tra infezione da virus BK e carcinoma uroteliale.
Infezione Batterica
Numerosi ricercatori hanno suggerito che le infezioni batteriche croniche possono giocare un ruolo nella formazione del cancro della vescica (Davis et al, 1991). Clinicamente, l'uso cronico del catetere, calcoli, e le infezioni sono associati al carcinoma della vescica, ma il meccanismo di formazione neoplastico non è ben compreso (Abol-Enein, 2008).
Il meccanismo d'azione può essere correlato alla produzione di sostanze cancerogene come le nitrosammine che possono essere prodotte con le infezioni croniche delle vie urinarie (Radomski et al, 1978). In un modello animale, i ratti con un’infezione delle vie urinarie producono un aumento di livelli urinari di N-N1 dimetilnitrosamina per un periodo di 24 settimane, e questo è stato associato ad iperplasia uroteliale e precoci alterazioni neoplastiche dell'urotelio. I potenziali agenti cancerogeni sono stati prodotti principalmente con infezioni causate da Escherichia coli e Pseudomonas. Una revisione retrospettiva della letteratura pubblicata suggerisce che le infezioni croniche delle vie urinarie sono associate al cancro della vescica, riportando un 14 a 16 il rischio relativo di sviluppare il cancro della vescica per una storia di infezione del tratto urinario rispetto a nessuno (Abol-Enein, 2008).
Tuttavia, non vi è stato alcuno studio prospettico esaminato tra l'associazione di infezioni del tratto urinario e rischio di cancro alla vescica. Resta possibile che l'associazione positiva tra l'infezione e il cancro uroteliale è guidato da pregiudizi di rilevamento o il richiamo preferenziale tra casi e controlli. Infine, un ampio studio caso-controllo dagli Stati Uniti sulla base di dati dalla vescica Cancer Study Group Nazionale ha riportato un rischio relativo 4,8 (CI, 1,9-11,5) della formazione di cancro alla vescica per i soggetti con maggiore o uguale a tre infezioni del tratto urinario rispetto a nessuna (Kantor et al, 1984).
Precedenti infezioni di gonorrea sono state associate alla formazione di cancro uroteliale. In uno studio caso-controllo per età, sesso, fumo e altri fattori confondenti, il rischio relativo di formazione di tumore uroteliale era da 2.1 a 2.4 (La Vecchia et al, 1991).
Uno studio prospettico ha trovato un rischio relativo 1.92 (CI, 1,0-3,3) di formazione del cancro della vescica negli uomini con una storia di gonorrea (Michaud et al, 2007). Una precedente infezione di gonorrea era più associata ai tumori invasivi e non invasivi. Questi studi suggeriscono che l'infezione di gonorrea può essere associata alla formazione del cancro della vescica, e ulteriori studi prospettici sarebbero garantiti.
2.9 Radiazioni
La potenziale associazione tra l'esposizione alle radiazioni e la formazione di cancro della vescica si basa principalmente sui sopravvissuti alla bomba atomica durante la Seconda Guerra Mondiale (Ron et al, 1994; Thompson et al, 1994; Pierce et al, 1996; Hall, 2008). Dal 1950, sono state monitorate 86.572 persone che sono state esposte alle radiazioni della bomba atomica. Il 73% aveva una bassa dose di esposizione (inferiore a 50 mSv), e il 6% fu esposto a dosi molto elevate di radiazioni (più di 500 mSv). Vi è un significativo aumento del rischio di morte con qualsiasi tipo di cancro se una persona è esposta ad un valore di radiazioni superiore a 50 mSv. Per il tumore uroteliale, il rischio relativo di formazione di tumore è 1,63 negli uomini e 1,74 nelle donne. È interessante notare che, la formazione del cancro uroteliale dopo la radiazione non è legata all'età, ma al periodo di latenza da 15 a 30 anni. Sostengono inoltre che le radiazioni possono causare un aumento di rischio al cancro uroteliale della vescica in quei pazienti con prostata o il cancro del collo dell'utero che sono stati trattati con radioterapia (Boice et al, 1988; Neugut et al, 1997; Brenner et al, 2000). Anche la radiazione da più di sei TC in un dato anno è associata a tumori secondari (Hansen e Jurik, 2009). Tuttavia, non vi è alcuna associazione con basse dosi o l'esposizione industriale di radioterapia e la formazione del cancro della vescica. È importante sottolineare che i tecnici urologici o i lavoratori esposti alle radiazioni nucleari non hanno un aumentato rischio di formazione di tumore uroteliale (Sont et al, 2001; Mohan et al, 2003; Sigurdson et al, 2003).
2.10 Chemioterapia
La chemioterapia distrugge le cellule maligne provocando significativo danno cellulare e del DNA, ma può anche avere un effetto profondo sulla rapida divisione del normale epitelio, come nella vescica. L'unico agente chemioterapico che ha dimostrato di causare il cancro della vescica è la ciclofosfamide (Travis et al, 1995; Nilsson e Ullen, 2008). Il rischio di formazione di cancro alla vescica è linearmente correlato alla durata e all'intensità del trattamento ciclofosfamide, sostenendo un ruolo causale. Phosphoramide mustard è il metabolita primario mutageno che provoca cancro alla vescica in pazienti esposti a ciclofosfamide.
2.11 Eredità
I Parenti di primo grado di pazienti con cancro alla vescica hanno un duplice aumento del rischio di sviluppare il cancro uroteliale, male famiglie ad alto rischio di cancro uroteliale sono relativamente rare (Aben et al, 2002; Murta-Nascimento et al, 2007; Kiemeney, 2008) . Il rischio ereditario sembra essere maggiore per le donne e non fumatori, ma non è correlato all'esposizione al fumo di seconda mano nelle famiglie. Il rischio ereditario di formazione di cancro alla vescica sembra interessare tutte le fasi di carcinoma uroteliale e non è associato alla formazione di cancro della vescica in età precoce. Purtroppo, non ci sono chiari modelli di eredità mendeliana, rendendo impossibili gli studi di linkage classico.
Molto probabilmente, c’è una varietà di geni a bassa penetranza che può essere ereditata e che rende una persona più suscettibile all'esposizione cancerogena, aumentando così il rischio di formazione di cancro alla vescica.
Ci sono due geni ad alta penetranza che sono associati al carcinoma uroteliale: RB1 e CDC91L1 (Fletcher et al, 2004; Guo et al, 2004). In un recente studio, ci sono stati cinque casi di cancro alla vescica da 144 pazienti con retinoblastoma noto, con un conseguente rischio relativo di 26,3 rispetto a quelli senza retinoblastoma (Fletcher et al, 2004). CDC91L1 è stato scoperto nel 1996 ed è una traslocazione germinale di t (5; 20) (p15; q11), che si trova su 20q11 (Guo et al, 2004). Questo gene codifica per fosfatidilinositolo classe glicano U ed è amplificato in un terzo dei carcinomi uroteliali.
Il ruolo del gene non è chiaro, e la proteina espressa è sconosciuta in questo momento. Thelen e Schaeuble sono stati i primi a segnalare il raggruppamento familiare di carcinomi uroteliali nel 1957 individuando gemelli identici con papillomi uroteliali. Questa scoperta ha portato ad ulteriori valutazioni alla ricerca di una forma ereditaria di tumore uroteliale, che fino ad oggi si è dimostrato sfuggente.
3 Classificazione
3.1 Definizione di tumore alla vescica non muscolo invasivo
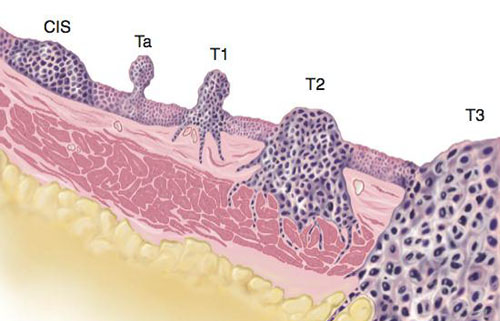
Secondo il sistema di classificazione TNM, un tumore papillare confinato alla mucosa rientra nello stadio Ta.
I tumori che hanno invaso la lamina propria si classificano nello stadio T1.
Tumori Ta e T1 possono essere rimossi con la resezione transuretrale (TUR) e pertanto per fini terapeutici si raggruppano sotto la denominazione di NMIBC.
Sotto la stessa denominazione vengono inclusi anche quelli piani, tumori ad alto grado di differenziazione confinati alla mucosa e classificati come CIS (tis).
Tuttavia le tecniche di biologia molecolare e l’esperienza clinica hanno dimostrato l’alto potenziale maligno delle lesioni dei tumori Cis e T1. Si può affermare, quindi, che i termini tumore della vescica non muscolo invasivo e tumore superficiale della vescica sono descrizioni quasi ottimali. Quest’ultimo termine non dovrebbe più essere utilizzato dal momento che ogni volta che si usa la terminologia di tumore della vescica non muscolo invasivo, deve essere attribuito a casi singoli sia lo stadio del tumore che il suo grado.
3.2 Classificazione TNM
La classificazione TNM del 2002 è stata approvata dal Union International Contre le Cancer (UICC) ed ampiamente condivisa. Questa versione è stata pubblicata nel 2009 e non è cambiata per i tumori della vescica (Tab 3).
Tavola 3: 2009 TNM classificazione dei tumori alla vescica
|
T - Primary tumour |
|
TX Primary tumour cannot be assessed T0 No evidence of primary tumour Ta Non-invasive papillary carcinoma Tis Carcinoma in situ: ‘flat tumour’ T1 Tumour invades subepithelial connective tissue T2 Tumour invades muscle T2a Tumour invades superficial muscle (inner half) T2b Tumour invades deep muscle (outer half) T3 Tumour invades perivesical tissue: T3a Microscopically T3b Macroscopically (extravesical mass) T4 Tumour invades any of the following: prostate, uterus, vagina, pelvic wall, abdominal wall T4a Tumour invades prostate, uterus or vagina T4b Tumour invades pelvic wall or abdominal wall |
|
N - Lymph nodes |
|
NX Regional lymph nodes cannot be assessed N0 No regional lymph node metastasis N1 Metastasis in a single lymph node in the true pelvis (hypogastric, obturator, external iliac, or presacral) N2 Metastasis in multiple lymph nodes in the true pelvis (hypogastric, obturator, external iliac, or presacral) N3 Metastasis in common iliac lymph node(s) |
|
M - Distant metastasis |
|
MX Distant metastasis cannot be assessed M0 No distant metastasis M1 Distant metastasis |
3.3 Grado istologico del carcinoma uroteliale non muscolo invasivo della vescica.
Nel 1998, è stata proposta una nuova classificazione dei tumori uroteliali non invasivi dall’Organizzazione Mondiale della Salute (WHO) e dalla Società Internazionale di Patologie Urologiche (ISUP) (classificazione WHO ISUP 1998) e pubblicata dall’Organizzazione Mondiale della Salute nel 2004 (tavola 4). Il maggior contributo della pubblicazione è una descrizione istologica molto ben dettagliata dei vari gradi, che utilizza specifici criteri architetturali e citologici. Il sito web www.pathology.jhu.edu/bladder che illustra esempi dei vari gradi è stato sviluppato per migliorare ulteriormente l’accuratezza di utilizzo del sistema.
Table 4: classificazione WHO del 1973 e del 2004
|
1973 WHO grading Urothelial papilloma Grade 1: well differentiated Grade 2: moderately differentiated Grade 3: poorly differentiated 2004 WHO grading Flat lesions Hyperplasia (flat lesion without atypia or papillary aspects) Reactive atypia (flat lesion with atypia) Atypia of unknown significance Urothelial dysplasia Urothelial CIS Papillary lesions Urothelial papilloma (completely benign lesion) Papillary urothelial neoplasm of low malignant potential Low-grade papillary urothelial carcinoma High-grade papillary urothelial carcinoma |
Descrizione istologica dei vari gradi.
Lesioni uroteliali piane
|
Iperplasia (lesione piatta, senza atipie o aspetti papillari) |
L' iperplasia uroteliale piatta consiste di una mucosa molto ispessita, senza atipie citologiche. Piuttosto di richiedere un numero specifico di strati di cellule, un marcato ispessimento va diagnosticato come iperplasia piatta. Questa lesione può essere vista nella mucosa piana adiacente a lesioni uroteliali papillari di basso grado. Quando è osservata da sola non vi sono dati che suggeriscano un suo potenziale premaligno. |
|
Atipia reattiva (lesione piatta con Atipie) |
L'atipia reattiva (infiammatoria) consiste in anomalie nucleari in un urotelio acutamente o cronicamente infiammato. Nell'atipia reattiva i nuclei sono uniformemente ingranditi e vescicolari, con nucleolo centrale prominente. Le figure mitotiche possono essere frequenti. Una storia di cateterismo, di calcoli o di terapia è spesso presente. In assenza di ipercromasia e pleomorfismo nucleari apprezzabili o di irregolarità nella struttura cromatinica, la lesione non dovrebbe essere considerata neoplastica. |
|
Atipia uroteliale di significato sconosciuto |
In alcuni casi è difficile differenziare l'atipia reattiva e neoplastica. Ci può essere un maggiore grado di pleomorfismo e/o di ipercromasia sproporzionato rispetto al grado d'infiammazione, tale che la displasia non può essere esclusa con certezza. Questi casi dovrebbero essere indicati come "atipia di significato imprecisato" in modo che i pazienti siano seguiti più attentamente e rivalutati una volta che l' infiammazione scompare. |
|
Diplasia uroteliale |
L'urotelio displastico ha alterazioni citologiche e architetturali tali da essere ritenuto preneoplastico, tuttavia inferiori alla soglia diagnostica per il carcinoma in situ. |
|
Cis uroteliale |
Il carcinoma in situ è una lesione piana dell'urotelio che è un precursore documentato del carcinoma invasivo. La lesione è caratterizzata dalla presenza di cellule con grandi nuclei irregolari e ipercromici che possono essere presenti nell'intero spessore dell'epitelio o soltanto in parte di esso. L' attività mitotica è osservata frequentemente, spesso nella metà superiore dell'urotelio. Il carcinoma in situ comprende le lesioni che nel passato sono state indicate come displasia severa o marcata atipia. |
Lesioni papillari
|
Iperplasia papillare |
L'iperplasia papillare è caratterizzata da un leggero ondeggiamento o da una configurazione rilevata di un urotelio di spessore variabile, senza atipie nucleari. La lesione ha spesso uno o più vasi capillari dilatati alla base, ma manca di asse fibrovascolare ben sviluppato. |
|
Papilloma uroteliale (lesione completamente benigna).
|
Il papilloma uroteliale è definito come una crescita papillare discreta con assi fibrovascolari centrali rivestiti da urotelio normale per spessore e citologia Non vi è esigenza di conteggio del numero di strati di cellule. |
|
Neoplasia uroteliale papillare a basso potenziale maligno. |
La neoplasia uroteliale papillare a basso potenziale di malignità è una lesione uroteliale papillare con una disposizione ordinata delle cellule all'interno di papille con anomalie architetturali minime e atipie nucleari minime, indipendentemente dal numero di strati di cellule. L'urotelio è molto più spesso che nei papillomi e i nuclei sono significativamente ingranditi e un po' ipercromici. Le figure mitotiche sono rare e limitate solitamente allo strato basale. |
|
Carcinoma uroteliale papillare di basso grado |
I carcinomi uroteliali papillari di basso grado sono caratterizzati da un aspetto generale ordinato, ma con variazioni delle caratteristiche architetturali o citologiche facilmente riconoscibili anche a basso ingrandimento. Le variazioni di polarità e delle dimensioni, della forma e della struttura della cromatina dei nuclei definiscono un'atipia citologica minima ma evidente. Le figure mitotiche sono rare e presenti solitamente nella metà inferiore, ma possono essere viste in tutto lo spessore dell'urotelio. È importante riconoscere che all'interno di una singola lesione vi può essere una gamma di anomalie citologiche ed architetturali tali che l' intera lesione dovrebbe essere esaminata e classificata secondo il più alto grado di atipia presente. |
|
Carcinoma uroteliale papillare di alto grado |
I carcinomi uroteliali papillari di alto grado sono caratterizzati dal un aspetto parzialmente o completamente disordinato a basso ingrandimento. Il disordine deriva sia dalle anomalie architetturali sia da quelle citologiche. Dal punto di vista architetturale, le cellule sembrano raggruppate irregolarmente e l' epitelio è disorganizzato. Citologicamente si osserva uno spettro di pleomorfismo che varia da moderato a marcato. La cromatina nucleare tende ad essere raggruppata e i nucleoli possono essere prominenti. Le figure mitotiche, comprese le forme atipiche, sono presenti frequentemente in tutti i livelli dell'urotelio. Vi è l'opzione, nella diagnosi di carcinoma uroteliale papillare di alto grado, di commentare se si osserva marcata anaplasia nucleare. |
Tabella 4 fornisce i dettagli dei sistemi di classificazione dell'OMS del 1973 e del 2004.
La classificazione stilata dall’Organizzazione Mondiale della Salute del 2004 delle lesioni piane come si può vedere, include iperplasia uroteliale, atipia uroteliale reattiva, atipia di significato sconosciuto, displasia e Carcinoma in sito (CIS). l’Organizzazione Mondiale della Salute suddivide le lesioni papillari uroteliali non invasive in : neoplasia papillare uroteliale di basso potenziale maligno (PUNLMP) e carcinoma uroteliale a basso grado e alto grado.
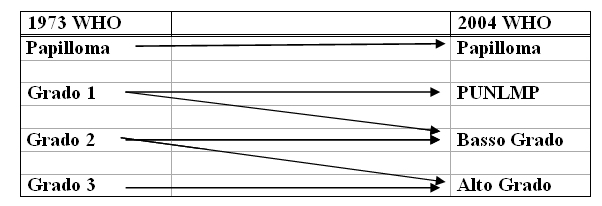
Le neoplasie papillari uroteliali a basso potenziale maligno (PUNLMP) vengono definite lesioni che non presentano caratteristiche citologiche di malignità ma mostrano cellule uroteliali normali in una configurazione papillare,alcune delle quali potrebbero essere state classificate come G1 nella classificazione WHO del 1973. Sebbene abbiano un trascurabile rischio di progressione, non sono completamene benigne e hanno comunque la tendenza a recidivare.
La categoria PUNLMP è riservata solo ai tumori Ta.
Il grado intermedio (grado 2) che fu soggetto di controversie nella classificazione fatta nel 1973 dalla WHO, è stato eliminato dalla classificazione 2004. I confronto pubblicati, tuttavia, non ha chiaramente confermato che la classificazione del 2004 dell’Organizzazione Mondiale della Salute ha una migliore riproducibilità della classificazione del 1973 .
Il valore prognostico di entrambi i sistemi di graduazione sono stati confermati. I tentativi di dimostrare tra i due valori prognostici il migliore hanno dato risultati controversi. La maggior parte degli studi clinici pubblicati sino ad oggi sul tumore alla vescica Ta e T1 sono stati effettuati utilizzando la classificazione del 1973, e pertanto le linee guida da seguire si basano su questa versione. Fino a quando il ruolo prognostico dall’Organizzazione Mondiale della Salute del 2004 non viene convalidato da maggior studi prospettici, entrambe le classificazioni possono essere utilizzate.
Figura 1: stratificazione dei tumori secondo le classificazioni WHO 1973 e 2004*
3.4 Variabilità Inter and intraosservatore in stadi e gradi.
Nonostante i criteri per la diagnosi di carcinoma uroteliale siano ben definiti, esiste una significativa variabilità tra patologi per la diagnosi del Carcinoma in situ, per cui si ottiene un accordo solo nel 70-78% dei casi.
C’è variabilità interosservatore nella classificazione dello stadio T1 contro i tumori Ta e gradazione di tumori in entrambe le classificazioni 1997 e 2004.
La conformità generale nella stadi azione e graduazione è compresa tra il 50% e 60%.
In casi difficili si raccomanda un ulteriore revisione da parte di un patologo genitourinario.
3.5 ulteriori parametri patologici promettenti.
Alcuni nuovi parametri, basati su esami anatomo-patologici di tessuti resecati sono stati valutati e considerati in sub classificazioni per fini prognostici.
In pazienti con un tumore T1 si possono valutare, la profondità ed estensione dell’invasione nella lamina propria (T1 sottostadiazione). Il valore prognostico di questa valutazione è stato dimostrato da alcuni studi retrospettivi di coorte . la presenza di invasioni linfovascolari è stata riportata come fattore prognostico sfavorevole nei tumori T1 .Gli stessi devono essere presentati nelle diagnosi.
Il rilevamento della variante di carcinoma uroteliale micropapillare rappresenta un fattore prognostico negativo anche se non muscolo invasiva al momento della diagnosi . Nei tumori uroteliali micropapillari con invasione T1, sono stati confermati alcuni casi con metastasi a distanza. Inoltre, il rischio di sottostadiazione in questi tumori è sostanziale.
Rari casi di carcinoma non-invasivo a cellule squamose della vescica con prognosi infausta sono stati descritti. Marcatori molecolari, in particolare lo stato di mutazione FGFR3, sono promettenti ma necessitano di ulteriori valutazione .
3.6 Specificità dei CIS e classificazione clinica.
CIS è un carcinoma uroteliale non invasivo, piatto, di alto grado di differenziazione. Macroscopicamente il CIS può non essere rilevato dalla cistoscopia, oppure essere confuso per una lesione infiammatoria se non viene effettuata la biopsia. È spesso multifocale e può verificarsi non solo nella vescica, ma anche nel tratto urinario superiore, dotti prostatici, e uretra prostatica .
Il CIS viene classificato in uno dei quattro diversi tipi clinici:
• primario: CIS isolato senza tumori papillari precedenti o concomitanti e non precedenti CIS;
• secondario: CIS rilevato durante il follow-up di pazienti con un tumore precedente che non era CIS;
• Concorrente: CIS in presenza di qualsiasi altro tumore uroteliale della vescica;
• Ricorrente: CIS isolati che si verificano ripetutamente a seguito di iniziale risposta positiva al trattamento intravescicale.
4. diagnosi
4.1 Storia del paziente
La storia del paziente dovrebbe essere presa e registrata per tutte le informazioni importanti per dei possibili collegamenti al BC, compresi i fattori di rischio e la storia di sintomi sospetti.
4.2 Sintomi
L'ematuria è il reperto più comune nel NMIBC. i tumori Ta, T1 non causano dolore vescicale e raramente si presentano con sintomi alle basse vie urinarie (LUTS). Nei pazienti che lamentano questi sintomi, soprattutto in quelli con LUTS irritative refrattarie al trattamento sintomatico, il CIS potrebbe essere sospetto.
4.3 Esame fisico
L'esame fisico non rivela NMIBC.
4.4 Imaging
4.4.1 urografia endovenosa e tomografia computerizzata
L’Urografia endovenosa (IVU) è utilizzata per rilevare difetti di riempimento dei calici, pelvi renali e ureteri, e idronefrosi, che può indicare la presenza di un tumore ureterale. I grandi tumori esofitici possono essere visti come difetti di riempimento della vescica. La necessità di eseguire IVU di routine una volta che è stato rilevato un tumore della vescica, viene messa in discussione a causa della bassa incidenza di risultati significativi ottenuti con questo metodo.
L'incidenza di tumori del tratto urinario superiore è basso (1,8%), ma aumenta al 7,5% nei tumori localizzati nel trigono . Il rischio di recidiva del tumore nel tratto urinario superiore durante follow-up aumenta per i tumori multipli e ad alto rischio .
Nella maggior parte dei centri, la tomografia computerizzata (TC) urografica è usata come alternativa al tradizionale IVU . Soprattutto nei tumori muscolo-invasivo della vescica e nei tumori del tratto urinario superiore. Dà più informazioni di quanto non dà IVU(incluso lo stato dei linfonodi e degli organi vicini). Tuttavia, la TC ha lo svantaggio di esposizione alle radiazioni superiore rispetto all’IVU.
4.4.2 ecografia
L'ecografia (US) è spesso usata come strumento iniziale per valutare il tratto urinario. Questo non solo perché evita l'uso di mezzi di contrasto, ma anche perché trasduttori sensibili hanno migliorato l'immagine del tratto urinario superiore e della vescica.
L’ecografia Transaddominale ci permette la caratterizzazione delle masse renali, rileva idronefrosi, e visualizza masse endoluminali nella vescica. Può essere accurata come l’IVU per la diagnosi dell’ostruzione del tratto urinario superiore . US è quindi un utile strumento per il rilevamento di ostruzione in pazienti con ematuria, tuttavia, non può escludere la presenza di tumori del tratto superiore.
Il CIS non può essere diagnosticato con metodi di immagine (IVU, urografia CT o US).
4.5 citologia urinaria
L'esame di campioni di urina o di campioni di lavaggio vescicale per le cellule tumorali esfoliate ha alta sensibilità in tumori ad alto grado, ma bassa sensibilità nei tumori a basso grado. La sensibilità della citologia per la rilevazione CIS è 28-100% . La Citologia è quindi utile quando è presente un tumore maligno ad alto grado o CIS. Tuttavia, la citologia urinaria spesso è negativa in presenza di tumori di basso grado. La citologia urinaria positiva può indicare un tumore uroteliale in qualsiasi parte del tratto urinario, dal calice agli ureteri, vescica e uretra . La citologia negativa, tuttavia, non esclude la presenza di un tumore nel tratto urinario.
Interpretazione citologico è user-dipendente ?(50). La valutazione può essere ostacolata da una bassa resa cellulare, infezioni del tratto urinario, pietre, o instillazioni endovescicale. In mani esperte tuttavia, la specificità supera il 90% . Citologia deve essere eseguita su urine fresche con fissaggio adeguato. Le urine del mattino non sono adatte a causa della frequente presenza di citolisi.
4.6 prove di marcatori molecolari urinari
Esistono requisiti generali specificati per i buoni markers del cancro della vescica :
• Il test deve essere tecnicamente più semplice possibile (preferibilmente un test point-of-care, con risultati immediatamente disponibili, facile da eseguire, con una breve curva di apprendimento);
• basso costo;
• Buona affidabilità e riproducibilità;
• Per le popolazioni di pazienti individuali e situazioni cliniche, il test dovrebbe avere una elevata specificità per evitare inutili iter a causa di risultati falsi-positivi, e alta sensibilità per evitare il rischio di non diagnosticare un tumore;
• Per le impostazioni cliniche, è della massima importanza rilevare il cancro uroteliale ad alto rischio prima che sfugga al trattamento curativo.
Spinto dalla bassa sensibilità della citologia urinaria, approfondite ricerche di laboratorio hanno sviluppato numerosi test urinari per il rilevamento del BC. Considerando la frequenza di cistoscopia per il follow-up, i markers per i carcinoma uroteliali ricorrenti sarebbero particolarmente utili.
Numerose recensioni dei marcatori urinari sono apparse negli ultimi anni. Nessuno di questi marcatori sono stati accettati come procedura diagnostica o di follow-up standard in urologia di routine o in linee guida. Alcuni test delle urine che sono stati valutati in diversi laboratori / centri e in studi con numero sufficiente di pazienti sono elencati nella Tabella 5. Sensibilità e specificità dovrebbero essere utilizzati per confrontare studi sui test delle urine perché rimangano costanti, mentre i valori predittivi positivi e negativi variano tra popolazioni con diverso numero di eventi positivi e negativi.
I seguenti è possibile trarre conclusioni circa i test esistenti. La sensibilità è di solito superiore al costo della specificità inferiore citologia urinaria (LE: 3). Condizioni benigne e BCG influenzano molti urinario test di marcatori (LE: 3). Sensibilità e specificità di un test marcatore urinario dipendono dal contesto clinico del paziente (di screening, rilevamento primaria, follow-up (ad alto rischio), e il follow-up (rischio basso / intermedio)(LE: 3). Ad esempio, la sensibilità di un dato marcatore urinario è maggiore per il rilevamento di una lesione primaria di un lesione ricorrente (LE: 3).
Tavola 5: Sintesi dei principali marcatori urinari
|
Marcatori o specifiche dei test |
Sensibilità complessiva (%) |
Specificità complessiva (%) |
Sensibilità per tumori d’alto grado (%) |
Point-of-care test |
Livello di evidenza (LE) |
|
UroVysion |
30 – 86 |
63 – 95 |
66 – 70 |
No |
3 |
|
Analisi microsatellite |
58 – 92 |
73 – 100 |
90 – 92 |
No |
1b |
|
Immunocyt/ uCyt + |
52 – 100 |
63 – 75 |
62 – 92 |
No |
3 |
|
Matrice nucleare proteina 22 |
47 - 100 |
55 – 98 |
75 – 83 |
Si |
3 |
|
BTA stat |
29 - 83 |
56 – 86 |
62 – 75 |
Si |
3 |
|
BTA TRAK |
53 - 91 |
28 - 83 |
74 – 77 |
No |
3 |
|
Citocheratine |
12 - 88 |
73 - 95 |
33 - 100 |
No |
3 |
A differenza di altri test delle urine, alcuni risultati falsi-positivi di UroVysion e analisi dei microsatelliti possono essere attribuito alla malattia occulta e quindi identificare quei pazienti che hanno maggiori probabilità di sperimentare successiva recidiva. Potrebbe anche essere utile per predire la risposta alla terapia intravescicale (LE: 3).