TUMORE DEL TESTICOLO
INTRODUZIONE
Il tumore del testicolo rappresenta fra l’1,5% e il 5% delle neoplasie maschili e il 5% dei tumori urologici,con un’incidenza di 3-10 nuovi casi ogni 100.000 uomini.E’ tipico dei paesi occidentali industrializzati.Nell’1-2% dei casi la neoplasie è bilaterale.Nel 90-95% è un tumore delle cellule germinali.Per i tumori non-seminoma l’incidenza massima è nella III decade mentre per il seminoma nella IV decade.
I fattori di rischio sono i seguenti:storia di criptorchidismo,sindrome di Klinefelter,storia di tumore testicolare in parenti di I° grado,la presenza di tumore controlaterale e infertilità.
CLASSIFICAZIONE ISTOLOGICA
La seguente classificazione è dell’OMS
1-TUMORE DELLE CELLULE GERMINALI
- Neoplasia delle cellule germinali intratubulari,tipo non classificato (IGCN)
- Seminoma (inclusi i casi di cellule sinciziotrofoblastiche)
- Seminoma spermatocitico
- Carcinoma embrionale
- Tumore del sacco vitellino
- Corioncarcinoma
- Teratoma(maturo,immaturo,con componente maligna)
- Tumori con più di un tipo istologico
2-TUMORI NON GERMINALI(TUMORI DELLE CELLULE GERMINALI)
- Tumore delle cellule del leydig
- Tumore maligno delle cellule del Leydig
- Tumore delle cellule del Sertoli
- Variante lipidica
- Variante sclerosante
3.Variante a grandi cellule calcificate
- Tumore maligno delle cellule del Sertoli
- Tumore delle cellule della granulosa(tipo adulto,tipo giovanile)
- Tecoma
- Altri tumori non germinali (misto,non completamente differenziato)
- Tumori contenenti cellule germinali/non germinali (gonadoblastoma)
3-TUMORI MISCELLANEI
- Tumori dell’epitelio ovarico
- Tumore dei dotti collettori e rete testis
- Tumori di stroma non-specifico (benigni e maligni)
DIAGNOSI
- ESAME CLINICO
Di solito la neoplasia appare come uma massa scrotale unilaterale e indolore o come massa intrascrotale trovata casualmente.Nel Il tumore del testicolo colpisce di solito fra la III e la IV decade di vita.Nel 20% dei casi il primo sintomo è il dolore scrotale,in più del 27% dei pazienti si trova dolore locale.Occasionalmente un trauma testicolare può rilevare una massa intrascrotale.La ginecomastia appare nell’7% dei casi ed è più comune nei tumori non seminomatosi.Nell’11% dei casi è presente dolore alla schiena e al fianco.La sintomatologia può simulare un orchiepididimite e questo ritarda la diagnosi.Nei casi dubbi si utilizza l’ecografia.L’esame fisico rileva le caratteristiche della massa e deve essere sempre associata ad un esame clinico generale allo scopo di trovare metastasi a distanza,una massa addominale palpabile o ginecomastia.
- IMMAGINE DEI TESTICOLI
L’ecografia serve per confermare la diagnosi di malattia e per esplorare il testicolo controlaterale.La sua sensibilità è intorno al 100% ed ha un importante ruolo per determinare la neoplasia sia intra che extratesticolare.L’ecografia è un test indispensabile e deve essere effettuata anche quando la malattia è evidente clinicamente.L’ecografia deve essere effettuata in giovani maschi senza masse testicolari palpabili che hanno masse viscerali o retroperitoneali o livelli elevati di alfa feto proteina(AFP) o gonadotropina corionica (beta HGC) o in uomini in consultazione per problemi di fertilità.
La risonanza magnetica offre maggiore sensibilità(100%) e specificità(95-100%) rispetto all’ecografia per la diagnosi di tumore,ma il suo costo elevato non giustifica il suo utilizzo per la diagnosi.
- MARKERS TUMORALI
I markers tumorali sono molto importanti per la prognosi,la diagnosi e la stadiazione della neoplasia.Sono i seguenti
- Alfa-feto proteina (prodotto dalle cellule del sacco vitellino)
- hCG (espressione del trofoblasto)
- LDH (lattato deidrogenasi)
In tutti i tumori,c’è un incremento di questi marker nel 51% dei casi di neoplasia testicolare.L’alfa-feto proteina aumenta nel 50-70% dei casi di neoplasia delle cellule germinali non seminomatose,nel 40% dei casi si è notato un incremento di hCG.Circa il 90% delle neoplasie non seminomatose si associa ad un aumento di uno o di entrambi i markers.Nei seminomi si assiste soprattutto all’aumento dell’hCG durante il corso della malattia.La LDH è un markers meno specifico degli altri e la sua concentrazione è legata al volume della neoplasia.La negatività di questi valori non esclude la presenza di una neoplasia testicolare.Un altro marker valutabile può essere la fosfatasi alcalina placentare,ma non è un valore raccomandato nella ricerca della neoplasia come i precedenti tre.
- ESPLORAZIONE INGUINALE E ORCHIECTOMIA
Ogni paziente con sospetto di neoplasia testicolare deve essere sottoposto a ispezione inguinale con esternalizzazione del testicolo senza la sua tunica.L’orchiectomia con divisione del funicolo spermatico nell’anello inguinale interno deve essere effettuata quando viene trovato un tumore maligno.Se la diagnosi non è chiara viene fatta una biopsia testicolare a freddo.In corso di malattia metastatica si procede inizialmente con chemioterapia prima di fare un’orchiectomia.
- CHIRURGIA ORGAN-SPARING
La chirugia organ-sparing non è consigliata in caso di neoplasia monolaterale,tale tipo di approccio può essere tentato in particolari circostanze.Nel tumore bilaterale sincrono,tumore metacrono controlaterale e nel tumore monolaterale con livelli preoperatori normali di testosterone,la preservazione dell’organo può essere effettuata se il volume del tumore è < 30% del volume totale del testicolo e se le regole chirurgiche sono rispettate.In questi casi tutti i pazienti devono essere trattati con radioterapia.La complicanza a lungo termine della radioterapia può essere l’infertilità.
- ESAME PATOLOGICO DEL TESTICOLO
Caratteristiche macroscopiche:dimensioni,volume,caratteristiche macroscopiche dell’epididimo
Caratteristiche microscopiche:presenza o assenza di tumore perivenoso e/o con infiltrazione linfatica,presenza o assenza di invasione di tonaca albuginea,tonaca vaginale,epididimo e funicolo spermatico.
Importante è anche la valutazione del TIN (neoplasia intratubulare).la biopsia controlaterale può essere fatta per fare diagnosi di TIN.La biopsia del testicolo controlaterale dovrebbe essere fatta nei pazienti a rischio:volume testicolare <12 ml,storia di criptorchidismo o scarsa spermatogenesi.In pazienti >40 anni è sconsigliata la biopsia controlaterale.La terapia per i TIN è la radioterapia (20 Gy frazionati in 2 Gy).Se la neoplasia è monolaterale e il paziente ha desiderio di avere figli è preferibile procedere a orchiectomia.
STADIAZIONE
- MARKERS TUMORALI:CINETICA DELL’EMIVITA POST-ORCHIECTOMIA
L’emivita di AFP è 5-7 giorni mentre quella dell’hCG è 2-3 giorni.Il valore dei markers è importante per la stadiazione e la prognosi.La persistenza di valori elevati di markers dopo orchiectomia indica la presenza di malattia metastatica.I valori dei markers dovrebbero diminuire durante il trattamento chemioterapico,qualora questo non dovesse accadere la prognosi della patologia peggiora.
4.2 marcatori tumorali sierici: cinetica emivita post-orchiectomia
La media emivita sierica di AFP e hCG è 5-7 giorni e 2-3 giorni, rispettivamente. I marcatori tumorali devono essere rivalutati dopo orchiectomia per determinare la cinetica dell’emivita. Il calo dei marker in pazienti con malattia in stadio I dovrebbe essere valutato fino a quando si verifica normalizzazione dei dati. I marcatori prima dell'inizio della chemioterapia sono importante per classificare il paziente in base alla cella Internazionale Germ Cancer Collaborative Group (IGCCCG)
classificazione del rischio. La persistenza di elevati marcatori tumorali nel siero dopo orchiectomia potrebbe indicare la presenza di malattia metastatica (macro-o microscopicamente), mentre la normalizzazione dei livelli di marcatori dopo orchiectomia non esclude la presenza di metastasi tumorali. Durante la chemioterapia, gli indicatori dovrebbero declinare; la persistenza ha un valore prognostico negativo
4.3 Linfonodi retroperitoneali, mediastinici e linfonodi sovraclaveari
Linfonodi retroperitoneali e linfonodi mediastinici sono meglio valutati per mezzo di un TC . I linfonodi sopraclaveari sono meglio valutati da un esame fisico . La tc addome-pelvi offre una sensibilità del 70-80 % nel determinare lo stato dei linfonodi retroperitoneali . la sua precisione dipende dalla dimensione dei linfonodi. La risonanza magnetica (MRI ) produce risultati simili alla TC nella rilevazione di allargamento linfonodale retroperitoneale. Ancora una volta , le principali obiezioni al suo uso di routine sono l' alto costo e la limitata disponibilità .Tuttavia , la risonanza magnetica può essere utile quando la TC addome-pelvi è controindicati a causa di allergia ai mezzi di contrasto , o quando il medico o il paziente sono preoccupati circa la dose di radiazioni . MRI è un test facoltativo.
4.4 Allestimento e classificazioni prognostici
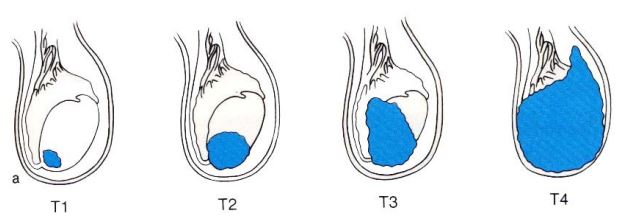
Il sistema di stadiazione raccomandato in queste linee guida è il TNM 2009 dell'Unione Internazionale Contro il Cancro (UICC). Questo comprende:
• determinazione dell'estensione anatomica della malattia;
• valutazione dei marcatori tumorali nel siero, compresi i valori di hCG, AFP e LDH dopo
orchiectomia (categoria S);
• chiara definizione di linfonodi regionali;
• alcune modifiche N-categorie relative alla dimensione del linfonodo.
Tabella 4 : classificazione TNM per il cancro testicolare ( UICC 2009 , 7 ° ediz )
PTX Il tumore primitivo non può essere valutato
PT0 Nessuna evidenza di tumore primitivo ( ad esempio cicatrice istologica nel testicolo )
pTis Neoplasia delle cellule germinali intratubulare ( neoplasia intraepiteliale testicolare )
pT1 Tumore limitato al testicolo e epididimo senza invasione vascolare / linfatica : tumore può
invadere la tunica albuginea ma non tunica vaginale
pT2 Tumore limitato al testicolo e epididimo con invasione vascolare linfatica / o tumore
si estende attraverso tunica albuginea con il coinvolgimento di tunica vaginale
pT3 Tumore che invade funicolo spermatico con o senza invasione vascolare / linfatica
pT4 Tumore che invade lo scroto con o senza invasione vascolare / linfatica
N linfonodi regionali
NX I linfonodi regionali non possono essere valutati
N0 No metastasi linfonodali regionali
N1 Metastasi con massa linfonodale 2 cm o meno nella dimensione massima o linfa multipla
nodi , nessuno più di 2 cm di dimensione massima
N2 Metastasi con massa linfonodale superiore a 2 cm ma non più di 5 cm più grande
dimensione , o più linfonodi , uno qualsiasi di massa superiore a 2 cm ma non superiore a 5 cm
dimensione massima
N3 Metastasi con massa linfonodale superiore a 5 cm di dimensione massima
M metastasi
MX Metastasi a distanza non può essere valutata
M0 No metastasi a distanza
M1 metastasi a distanza
M1a Linfonodo non regionale linfatico o polmonari
M1b altri siti
Marcatori tumorali sierici
Sx studi marcatori siero non disponibile o non eseguita
S0 livelli di studio marcatori siero entro i limiti
Stadio IA:i pazienti hanno il tumore primario limitato al testicolo e epididimo , senza evidenza di microscopiche invasioni vascolari o linfatiche da parte delle cellule tumorali al microscopio , nessun segno di metastasi all'esame clinico o immagini, e livelli marker tumorali post-orchiectomia nel siero entro i limiti normali . Il calo dei marker in pazienti con stadio clinico I dovrebbe essere valutato fino alla normalizzazione . Pazienti in stadio IB hanno più tumore primario invasivo a livello locale , ma nessun segno di malattia metastatica . Nei pazienti che hanno i livelli sierici dei marker del tumore dopo orchiectomia persistentemente elevato ,questa è la prova di metastasi subcliniche (o eventualmente un secondo tumore a cellule germinali nel testicolo rimanente) . Se i livelli di marcatori tumorali nel siero sono in declino secondo il decadimento emivita prevista dopo orchiectomia , il paziente viene solitamente seguita fino alla normalizzazione .
In grandi studi basati sulla popolazione , il 75-80% dei pazienti con seminoma , e circa il 55% dei pazienti con cancro NSGCT ha una malattia in stadio I al momento della diagnosi ( 86,87 ) .
Nel 1997 , il IGCCCG ha definito un sistema di stadiazione prognostico factor- based per tumore del testicolo metastatico in base all’identificazione di alcuni fattori clinici avversi indipendenti . Questo sistema di stadiazione è stato incorporato nella classificazione TNM e utilizza istologia, la posizione del tumore primario, la posizione delle metastasi e i livelli dei marker prechemiotherapici nel siero come fattori prognostici per classificare i pazienti in prognosi 'buona', 'intermedia' o ‘severa’.
4.5 fattori di rischio prognostici
Retrospettivamente, per il seminoma di stadio I, dimensioni del tumore (> 4 cm) e l'invasione della rete testis sono stati identificati come predittori di recidiva in un pool di analisi.
Per il non seminoma stadio I, invasione vascolare o linfatica del tumore primario è il più importante predittore della malattia metastatica occulta. Il tasso di proliferazione, così come la percentuale di carcinoma embrionale, sono predittori addizionali che migliorano il valore predittivo positivo e negativo di invasione vascolare.
I fattori di rischio significativi patologici prognostici per lo stadio I e i fattori di rischio clinici per la malattia metastatica sono
elencati qui sotto.
Fattori prognostici per malattia metastatica occulta nel tumore del testicolo per seminoma e per i non- seminoma
Tipo istopatologico dimensioni • tumore (> 4 cm)
• Invasione della rete testis
• invasione linfatica / vascolare del tumore primario
• tasso di proliferazione > 70 %
• Percentuale di carcinoma embrionale > 50%
Clinica ( per la malattia metastatica )
• Percorso primario
• Elevazione dei livelli di marker tumorali
• Presenza di non -polmonare metastasi viscerali
4.6 Impatto sulla fertilità e problemi di fertilità associati
Anomalie dello sperma si trovano frequentemente in pazienti con tumori del testicolo . Inoltre , la chemioterapia e la radioterapia possono anche ridurre la fertilità . Nei pazienti nella fascia di età riproduttiva , la valutazione della fertilità pre –trattamento (testosterone , ormone luteinizzante [ LH ] e livelli di FSH ) e l’analisi dello sperma devono essere eseguiti ,la crioconservazione dovrebbe essere proposta . Se la crioconservazione è desiderata, dovrebbe preferibilmente essere eseguita prima dell’orchiectomia , ma in ogni caso prima del trattamento chemioterapico.
In caso di orchiectomia bilaterale o bassi livelli di testosterone dopo il trattamento di TIN ,la supplementazione di testosterone per tutta la vita è necessaria. Ai pazienti con orchiectomia monolaterale o bilaterale dovrebbe essere proposta una protesi testicolare . Per informazioni più dettagliate , si rimanda il lettore alla EAU infertilità maschile .
5. LINEE GUIDA PER LA DIAGNOSI E STADIAZIONE DEL CANCRO DEL TESTICOLO
L’orchiectomia e l'esame patologico del testicolo sono necessari per confermare la diagnosi e
definire l'estensione locale (categoria pT). In una situazione di pericolo di vita a causa di ampie metastasi,
la chemioterapia deve essere avviato prima orchiectomia.
La determinazione sierica di marcatori tumorali (AFP, hCG e LDH) deve essere eseguita sia prima che
5-7 giorni dopo orchiectomia per la stadiazione e motivi prognostici inoltre deve essere valutato
lo stato dei linfonodi retro peritoneali, mediastinici e sovraclaveari.
6. TRATTAMENTO: STADIO I TUMORI A CELLULE GERMINALI
6.1 Stage I seminoma
Dopo moderne procedure di stadiazione, circa il 15-20% di seminoma allo stadio I hanno metastasi subcliniche, di solito nel retro peritoneo.
6.1.1 sorveglianza
Sono stati condotti numerosi studi prospettici di sorveglianza non randomizzati negli ultimi dieci anni,il più
grande studio proviene dal Canada con> 1.500 pazienti. Precedenti analisi di quattro studi hanno mostrato un tasso privo di recidiva a 5 anni del 82,3%. Il tasso di sopravvivenza globale cancro-specifica riportata sotto sorveglianza effettuata dai centri di esperti è 97-100 % per lo stadio I seminoma . Lo svantaggio principale di sorveglianza è la necessità di una maggiore intensità di follow - up , in particolare con gli esami di imaging ripetuti dei linfonodi retroperitoneali , per almeno 5 anni dopo orchiectomia . Questo si confronta con il rischio molto basso di recidiva sottodiaframmatica dopo radioterapia adiuvante.C'è un piccolo ma clinicamente significativo rischio di recidiva più di 5 anni dopo orchiectomia per il seminoma in fase I, che sostiene la necessità di un controllo a lungo termine .
6.1.2 La chemioterapia adiuvante
Uno studio congiunto da parte del Medical Research Council ( MRC ) e l'Organizzazione Europea per la Ricerca e la Cura del Cancro ( EORTC ) ( MRC TE 19 trial) , che ha confrontato un ciclo di carboplatino con la radioterapia adiuvante , non ha mostrato una differenza significativa per quanto riguarda la percentuale di recidiva , il tempo alla recidiva e la sopravvivenza dopo un follow - up di 4 anni . Pertanto, la terapia adiuvante con carboplatino è un'alternativa alla radioterapia o di sorveglianza nello stadio I del seminoma . Due cicli di carboplatino sembrano ridurre ulteriormente il tasso di recidiva dell'ordine del 1-3 % , ma sono necessari ulteriori esperienze e di osservazione a lungo termine .
6.1.3 La radioterapia adiuvante
Le cellule del seminoma sono estremamente radiosensibili . La radioterapia adiuvante per il campo para –aortici (PA) o ad un campo hockeystick (nodi para - aortici e iliaci omolaterali ), con dosi moderate ( totale 20-24 Gy ) , ridurrà il tasso di ricaduta al 1-3 % . Dopo la radioterapia moderna , quasi tutte le ricadute in primo luogo possono avvenire al di fuori del campo irradiato ( linfonodi sopradiaframmatici o nei polmoni ) . Sulla base dei risultati di un grande studio randomizzato MRC , Fossa et al hanno consigliato la radioterapia a un campo PA come trattamento standard per pazienti con stadio I del seminoma testicolare, T1 - T3 e con il drenaggio linfatico indisturbati . La tossicità acuta era ridotta e il numero di spermatozoi entro i primi 18 mesi è stato significativamente più elevato dopo irradiazione PA che dopo irradiazione del campo dogleg tradizionale. D'altra parte , il tasso di recidiva nei linfonodi iliaci era 2 % ( tutti sul lato destro ) dopo PA e 0 % dopo irradiazione dogleg . Un altro possibile sito di fallimento è nell’ ilo renale sinistra.Irradiazione PA dovrebbe essere adattata secondo il sito del tumore primario .Irradiazione adiuvante dei linfonodi sopradiaframmatici non è indicato in seminoma stadio I.Per quanto riguarda la dose di irradiazione , il MRC recentemente ha terminato un ampio studio randomizzato di 20 Gy rispetto a 30 Gy nella radiazione PA in stadio I del seminoma che ha mostrato l'equivalenza per entrambe le dosi in termini di tassi di recidiva .Il tasso di grave tossicità a lungo termine indotti dalle radiazioni è < 2 % .Effetti collaterali gastrointestinali cronici moderati sono visti in ~ 5 % dei pazienti , e moderata tossicità acuta GI in ~ 60 % . La preoccupazione principale che circonda la radioterapia adiuvante è l'aumento del rischio di secondi tumori maligni delle cellule germinali non indotte da radiazion . Uno scudo scrotale può essere di beneficio durante radioterapia adiuvante per evitare radiazioni diffusa e tossicità nel testicolo controlaterale .
6.1.4 Dissezione dei linfonodi retroperitoneali ( RPLND )
In uno studio prospettico non- randomizzato di confronto la radioterapia e RPLND nello stadio I del seminoma , c’era una tendenza verso una maggiore incidenza di recidive retroperitoneali ( 9,5 % ), dopo RPLND come trattamento primario .
Pertanto , questa politica non dovrebbe essere raccomandato in I seminomi di stadio I .
6.1.5 Trattamento rischio adattato
Utilizzando le dimensioni del tumore > 4 centimetri e invasione della rete testis , i pazienti con seminoma stadio I possono essere suddivisi in un gruppo ad alto rischio – basso rischio per la malattia metastatica occulta . Pazienti con e senza entrambi i fattori di rischio hanno un rischio di malattia occulta del 32 % e 12% , rispettivamente. Questi fattori di rischio sono stati introdotti da un'analisi di studi retrospettivi . Uno studio prospettico sulla base di questi fattori di rischio ha mostrato la fattibilità di un approccio di rischio adeguato. I primi dati con limitato follow-up indicano che i pazienti che non hanno fattori di rischio hanno un rischio 6,0% di recidiva a 5 anni.I pazienti nel gruppo ad alto rischio trattati con carboplatino hanno registrato un tasso di recidiva del 1,4% al follow-up medio di 34 mesi.
6.2 Linee guida per il trattamento del seminoma allo stadio I
La sorveglianza è l'opzione consigliata.Si raccomanda a base di carboplatino - chemioterapia .Il trattamento adiuvante non è raccomandato per i pazienti a rischio molto basso . La radioterapia non è raccomandata come trattamento adiuvante .
6.3 NSGCT fase I
Fino al 30% dei pazienti NSGCT con malattia allo stadio clinico I ( CS1 ) hanno metastasi subcliniche e ci saranno ricadute se solo la sorveglianza viene applicato dopo orchiectomia .
6.3.1 sorveglianza
Miglioramenti nella stadiazione clinica e metodi di follow-up , e la disponibilità di trattamento di salvataggio efficace con chemioterapia a base di cisplatino e chirurgia post- chemioterapia , hanno portato a studi di stretta sorveglianza dopo orchiectomia in pazienti CS1 NSGCT . Le più grandi relazioni sulla strategia di sorveglianza indicano un tasso di ricaduta cumulativo di circa il 30 % , con il 80% delle ricadute che si verificano durante i primi 12 mesi di follow - up , il 12% durante il secondo anno e il 6% durante il terzo anno , in calo dell'1% nel quarto e quinto anno , e a volte anche più tardi . Circa il 35 % dei pazienti recidivanti hanno normali livelli di markers sierici tumorali alla recidiva . Circa il 60 % delle recidive sono nel retroperitoneo . Nonostante stretto follow - up , l'11 % dei pazienti presentavano recidiva di malattia di grande volume .
6.3.2 chemioterapia primaria
Diversi studi che coinvolgono due cicli di chemioterapia con cisplatino , etoposide e bleomicina ( PEB ) come trattamento primario per pazienti ad alto rischio ( aventi rischio ~ 50 % di recidiva ) sono stati segnalati . in questi studi, coinvolgendo > 200 pazienti , alcuni con un follow- up di quasi 8 anni , un tasso di recidiva di soli 2,7 % è stata riportata , tossicità a lungo termine molto bassa .Fare due cicli di base di cisplatino come chemioterapia adiuvante non sembra influenzare negativamente la fertilità o l'attività sessuale . Tuttavia , il termine molto lungo( > 20 anni ) fa sì che gli effetti collaterali della chemioterapia adiuvante in questa impostazione sono attualmenti sconosciuti , e questo dovrebbe essere preso in considerazione per il processo decisionale ; soprattutto gli effetti cardiovascolari a lungo termine della chemioterapia in sopravvissuti GCT.È importante essere consapevoli di crescita lenta di teratomi retroperitoneale dopo chemioterapia primaria.
6.3.3 Trattamento rischio adattato
Il trattamento del rischio adattato si basa sulla invasione vascolare come fattore di rischio in pazienti con CS1 NSGCT.Se viene applicato il criterio di rischio adeguato , ai pazienti con invasione vascolare si raccomanda di sottoporsi a chemioterapia adiuvante con due cicli di PEB e ai pazienti senza invasione vascolare si raccomanda di sottoporsi a sorveglianza . Solo se i pazienti o medici non sono disposti ad accettare il trattamento a rischio adattato conseguente.La decisione circa il trattamento dovrebbe essere basata su una discussione approfondita con il paziente ,tenendo conto dei vantaggi e svantaggi descritti , nonché la situazione individuale del paziente e / o il centro di trattamento .Un progetto svedese-norvegese per il cancro ai testicoli ( SWENOTECA ) ha recentemente dimostrato che ,in un ampio studio basato sulla popolazione , con un approccio di rischio adattato all'interno di un programma di gestione e un follow-up mediano di 4,7 anni , il tasso di recidiva è stata del 3,2% per i pazienti con invasione vascolare trattati conun solo PEB adiuvante . Nel loro insieme , ~ 300 pazienti con alto rischio CS I sono stati trattati adjuvantlycon 1 x PEB con un follow- up di > 5 anni . Finché 1 x PEB non è sarà dimostrato superiore o almeno equivalentea 2 cicli PEB , questo trattamento adiuvante non può essere raccomandato al di fuori di uno studio clinico o un potenziale registro di sistema.
6.3.4 Dissezione dei linfonodi retroperitoneali
Se viene eseguita RPLND , ~ 30% dei pazienti si trovano ad avere metastasi linfonodali retroperitoneali , che corrisponde alla stadio patologico II ( PS2 )della malattia.Il principale fattore predittivo di recidiva in CS1 NSGCT gestito da sorveglianza, per avere la malattia PS2 e per la ricaduta in PS1 dopo RPLND , è la prova istopatologica di invasione vascolare da parte delle cellule tumorali . La presenza di invasione vascolare sembra essere un parametro molto importante , ed è clinicamente utilizzabile anche senza revisione centralizzata da parte di un panello di esperti . L’invasione vascolare era il fattore più predittivo in un'analisi multifattoriale . L'assenza di invasione vascolare ha un valore predittivo negativo del 77 % , consentendo così la sorveglianza in pazienti compatibili a basso rischio.I pazienti senza invasione vascolare costituiscono ~ 50-70 % della popolazione CS1 , e questi pazienti hanno solo un15-20% del rischio di recidiva durante la sorveglianza , rispetto ad un tasso di ricaduta del 50% in pazienti con invasione vascolare .Il rischio di recidiva per i pazienti PS1 è < 10% per coloro senza invasione vascolare e ~ 30 % per quelli coninvasione vascolare .Se i pazienti CS1 con PS2 sono seguiti solo dopo RPLND , ~ 30% recidiva , soprattutto in siti al di fuori dell'addome e del bacino. Il rischio di recidiva dipende dalla quantità di malattia retroperitoneale resecata . Se due( o più) cicli di chemioterapia a base di cisplatino sono dati come adiuvante RPLND in casi PS2 ,il tasso della ricaduta si riduce a < 2 % . Il rischio di recidiva retroperitoneale dopo RPLND nerve-sparing è molto basso se eseguita correttamente ( < 2 % ) , così come il rischio di disturbo eiaculatorio o di altri significativi effetti collaterali.Il follow -up dopo RPLND è molto più semplice e meno costoso di quello svolto durante la post- orchiectomia a causa della ridotta necessità di TC addominale . In un confronto randomizzato di RPLND con un ciclo di chemioterapia PEB , la chemioterapia adiuvante ha aumentato in modo significativo la sopravvivenza libera da recidiva a 2 anni al 99,41 % ( intervallo di confidenza [ CI] 95.87 % , 99.92 % ) al contrario di un intervento chirurgico , che ha avuto una sopravvivenza libera da recidiva a 2 anni del 92,37 % ( IC 87.21 % , 95.50 % ) .La differenza è del 7,04% , CI 2,52% , 11.56 % . L'hazard ratio per sperimentare una recidiva del tumore con la chirurgia al contrario di chemioterapia era 7,937 , CI 1.808 , 34.48 . Pertanto , un ciclo di PEB adiuvante è superiore a RPLND per quanto riguarda i tassi di recidiva in pazienti non stratificato per fattori di rischio. Nei dati SWENOTECA menzionati nel paragrafo 7.3.3 è stato anche riscontrato che uno PEB adiuvante ha ridotto il numero di recidive a 3,2% nei pazienti ad alto rischio e al 1,4 % nei pazienti a basso rischio .
6.4 CS1S con (persistentemente) elevati marcatori tumorali sierici
I marcatori tumorali sierici devono essere seguiti attentamente fino a che i livelli non rientrano nei valori di riferimento in base all’emivita attesa di AFP e hCG. Se il livello dei marker aumenta dopo orchiectomia, il paziente ha malattia residua. Se viene eseguito RPLND, fino al 87% di questi pazienti hanno malattia linfonodale nel retroperitoneo. Un esame ecografico del testicolo controlaterale deve essere eseguito, se questo non è stato fatto inizialmente. Il trattamento dei pazienti veri CS1S è ancora controverso. Essi possono essere trattati con tre cicli di primaria chemioterapia PEB e con follow-up per i pazienti CS1B (ad alto rischio) dopo la chemioterapia primaria, o da RPLND. La presenza di invasione vascolare può rafforzare l'indicazione per chemioterapia primaria.
6.5 Linee guida per il trattamento di NSGCT stadio I
Trattamenti rischio-adattato per CS1 a base di invasione vascolare
Fase NSGCT 1
Trattamenti adeguati ai rischi in CS1 a base di invasione vascolare o di sorveglianza senza la presenza di fattori di rischio sono raccomandati come opzioni di trattamento . Livello di evidenza A
Trattamenti di rischio - adattato per CS1 basati su invasione vascolare
CS1A ( pT1 , nessuna invasione vascolare ) : rischio basso
Se il paziente è disposto ed è in grado di rispettare una politica di sorveglianza a lungo termine ( almeno 5 anni ) vicino follow – up,dovrebbe essere raccomandato .Livello di evidenza A
Nei pazienti a basso rischio che non sono disposti a essere sottoposti a sorveglianza , la chemioterapia adiuvante o nerve-sparing RPLND sono le opzioni di trattamento . Se RPLND rivela PN + ( coinvolgimento linfonodale ) ,la chemioterapia con due cicli di PEB dovrebbe essere considerata.
CS1B ( pT2 - pT4 ) : alto rischio
Chemioterapia primaria con due cicli di PEB dovrebbe essere raccomandata ( un corso di PEB all'interno di uno studio clinico o Registro di sistema ) .Livello di evidenza A
La sorveglianza o nerve-sparing RPLND nei pazienti ad alto rischio rimane un'opzione per coloro che non sono disposti a sottoporsi a chemioterapia adiuvante .
Se si rileva in seguito a RPLND uno stadio patologico II ,dovrebbe essere considerata un uteriore chemioterapia .
7 TRATTAMENTO DEI TUMORI A CELLULE GERMINALI METASTATIZZATO
Il trattamento dei tumori germinali metastatici dipende :
• dall' istologia del tumore primario ;
• dai gruppi prognostici come definiti dalla IGCCCG basato su 5.202 casi di non- seminoma e 660 casi di seminoma .
7.1 a basso volume di malattia metastatica (stadio IIA / B )
7.1.1 Fase IIA / B seminoma
Finora , il trattamento standard per la fase II / B di un seminoma è stata la radioterapia. La dose di radiazioni erogata in stadio IIA e IIB è di circa 30 Gy e 36 Gy , rispettivamente. Il campo standard di radiazioni rispetto fase I sarà esteso dalla regione PA al campo iliaco ipsilaterale (il campo da hockey - stick). Nella fase IIB ,i bordi laterali dovrebbero includere i linfonodi metastatici con un margine di sicurezza di 1,0-1,5 cm . questa tecnica produce una sopravvivenza libera da recidiva in stadio IIA e IIB del 92 % e 90% , rispettivamente. La sopravvivenza globale è quasi il 100 % . Al contrario , la riduzione della dose di 27 Gy è stata associata con l'11 % di recidive.In fase IIB , la chemioterapia (4 x etoposide e cisplatino [EP ] o 3 x PEB in buona prognosi ) è un'alternativa alla radioterapia. Anche se più tossici nel breve termine , 4 x EP o 3 x PEB raggiungono un simile livello di controllo della malattia . L’agente singolo carboplatino non è un'alternativa alla EP standard o chemioterapia PEB .
7.1.2 Fase IIA / B non- seminoma
Vi è un consenso generale che il trattamento dovrebbe iniziare con la chemioterapia iniziale in tutti i casi avanzati di NSGCT fatta eccezione per la fase II della malattia NSGCT senza marcatori tumorali elevati , che in alternativa possono essere gestiti da RPLND primaria o di sorveglianza per chiarire lo stadio.
Se si sceglie di sorveglianza , un follow- up dopo 6 settimane è indicato per documentare se la lesione è in crescita ,è rimasto stabile o è in calo . Una lesione in regressione è probabile che sia di origine non maligna e si deve osservare ulteriormente . Una lesione stabile o in crescita indica o teratoma o un tumore maligno indifferenziato. Se la lesione sta crescendo senza un corrispondente aumento dei marcatori tumorali AFP o beta - hCG , la RPLND dovrebbe essere eseguita da un chirurgo esperto a causa di sospetti di teratoma . I pazienti con una lesione crescente e un concomitante aumento dei marcatori tumorali AFP o beta- hCG non devono sottoporsi ad intervento chirurgico ; richiedono chemioterapia PEB secondo l'algoritmo di trattamento per i pazienti con malattia metastatica e raccomandazioni per IGCCCG . Un'alternativa alla strategia di sorveglianza in marcatori negativi II A / B non seminoma con sospetto di un tumore maligno indifferenziato è una ( TC guidata ) biopsia , se tecnicamente possibile .I pazienti non disposti a sottoporsi a chemioterapia primaria hanno la possibilità di primaria RPLND nerve sparing con chemioterapia adiuvante ( due cicli di PEB ) in caso di malattia metastatica ( PII A / B ) . Chemioterapia primaria e RPLND primaria sono opzioni comparabili in termini di risultato, ma gli effetti collaterali e la tossicità sono diversi , permettendo il coinvolgimento del paziente nella scelta del trattamento di scelta . Il tasso di guarigione sarà vicino al 98%.
7.2 malattia metastatica avanzata
7.2.1 chemioterapia primaria
Il trattamento primario di scelta per la malattia avanzata è tre o quattro cicli di PEB combinati conchemioterapia , a seconda della classificazione rischio IGCCCG. Questo regime ha dimostrato superiorità a cisplatino , vinblastina e bleomicina ( PVB ), in pazienti con malattia avanzata .Bisogna sostenere un regime di 3 giorni di somministrazione di chemioterapia in combinazione per essere ugualmente efficace come al 5 giorno di regime , ma si associa ad un aumento della tossicità quando sono usati quattro cicli.
Tabella : regime PEB( intervallo di 21 giorni)
Farmaco Dosaggio Durata dei cicli
Il cisplatino 20 mg/m2 giorni 1-5 *
Etoposide 100 mg/m2 giorni 1-5
Bleomycin 30 mg giorni 1 , 8 , 15
* Più idratazione .
PEB = cisplatino , etoposide , bleomicina .
Per i pazienti con una ' prognosi scarsa ' , secondo la classificazione IGCCCG , il trattamento standard si compone di tre cicli di PEB , e solo in casi molto selezionati in cui la bleomicina è controindicata , quattro cicli di EP . Un trial randomizzato dal GETUG ha suggerito che quando il regime PEB è in corso,usato in questa impostazione, la mortalità è stata la metà di quella del PE , anche se la differenza non raggiungeva la significatività statistica . La terapia deve essere somministrata senza riduzione delle dosi ad intervalli di 21 giorni ; ritardare il seguente ciclo di chemioterapia è giustificato solo in caso di febbre con granulocitopenia < 1000/mm3 o trombocitopenia < 100.000 / UI . Non vi è alcuna indicazione per l'applicazione profilattico di fattori di crescita ematopoietici quali , per esempio , granulociti fattore stimolante le colonie ( G - CSF) . Tuttavia , si sono verificati se le complicanze infettive durante la chemioterapia , la somministrazione profilattica di G -CSF è raccomandato per i seguenti cicli .Il gruppo ' prognosi intermedia ' nell’ IGCCCG è stato definito come pazienti con una sopravvivenza a 5 anni con tasso del ~ 80 % . I dati disponibili supportano quattro cicli di PEB come trattamento standard. Per i pazienti con una ' prognosi ' , il trattamento standard consiste in quattro cicli di PEB . Quattro cicli di cisplatino , etoposide e ifosfamide ( PEI ) hanno lo stesso effetto , ma sono più mielotossici . La sopravvivenza a 5 anni libera da progressione è compresa tra il 45 % e il 50 % . Tre studi randomizzati hanno dimostrato qualche vantaggio della chemioterapia ad alta dose per il gruppo complessivo dei pazienti " prognosi infausta” . Tuttavia , i pazienti con un lento declino del marcatore dopo il primo o secondo ciclo possono rappresentare un sottogruppo di pazienti con prognosi inferior, con un potenziale ruolo per la chemioterapia dose- intensificato dopo il rilevamento di declino insufficiente del marcatore .La chemioterapia più aggressiva può anche essere studiata in un gruppo prognostico molto negativo ( esempio:cellule germinali del tumore primario in mediastino o metastasi cerebrali sincrone ) .I pazienti che soddisfano criteri di "cattiva prognosi“dovrebbero quindi essere trasferiti in un centro di riferimento perché un risultato migliore è stato segnalato per i pazienti con prognosi intermedia e negativa che erano stati trattati con uno studio clinico in un centro grande disponibilità. Non esistonomodifiche delle raccomandazioni generali per il trattamento dei pazienti con scadenti condizioni generali ( Karnofsky < 50%) o infiltrazione del fegato esteso ( > 50%) .I pazienti con infiltrazione polmonare avanzata sono a rischio di sindrome da distress respiratorio acuto : l'adeguamento delle dosi del regime PEB nel primo ciclo di chemioterapia ( solo 3 giorni di EP senza bleomicina ) è suggerito per ridurre il rischio di morte prematura in questo contesto .
7.3 Trattamento e ulteriore ristadiazione
7.3.1 Ristadiazione
La ristadiazione è eseguita da indagini di imaging e di rivalutazione dei marcatori tumorali . Al declino dei marcatori e stabile o regressiva manifestazionedel tumore , la chemioterapia sarà completata ( tre o quattro cicli , a seconda della fase iniziale). Nel caso di diminuzione del marcatore ma metastasi crescenti , la resezione del tumore è obbligatoria dopo la cessazione della terapia di induzione , se non in caso di emergenza , in base alla crescita locale del tumore locale. Nei pazienti con hCG di basso livello deve essere osservato il plateau del marcatore per vedere se si verifica una completa normalizzazione . Nei pazienti
con un livello di plateau nel siero di AFP basso dopo la chemioterapia ,deve essere eseguita la chirurgia delle masse residue , con monitoraggio post-operatorio di AFP . La chemioterapia di salvataggio è indicata solo per aumento di documentato .
7.3.2 resezione del tumore residuo
Una massa residua di seminoma non deve essere resecata , indipendentemente dalle dimensioni , ma controllata da indagini di imaging e marcatori tumorali.La FDG -PET ha un alto valore predittivo negativo nei pazienti con masse residue dopo il trattamento del seminoma ma i falsi positivi possono essere un problema e le scansioni non devono essere eseguiti < 2 mesi dopo la chemioterapia .Nei pazienti con residui di > 3 cm,la FDG- PET deve essere eseguito al fine di ottenere ulteriori informazioni sulla redditività di questi residui . In pazienti con residui di <3 cm l'uso di FDG - PET è facoltativo .In progressione , la terapia di salvataggio è indicata (chemioterapia , chirurgia di salvataggio , radioterapia) .In pazienti con aumento concomitante di hCG ,essendoci un seminoma in progressione dopo chemioterapia di prima linea,devono essere trattati da chemioterapia di salvataggio ( o radioterapia se è presente recidiva di piccolo volume) .I pazienti senza progressione di hCG dovrebbero essere sottoposti a verifica istologica (per esempio mediante biopsia o chirurgia a cielo aperto ) prima di iniziare la chemioterapia di salvataggio.Nel caso di un non- seminoma e remissione completa dopo chemioterapia (senza tumore visibile ) , non è indicata la resezione deltumore residuo . Il tasso di recidiva a lungo termine in questo gruppo di pazienti è 6-9 % , tuttavia, un terzo dei pazienti recidivanti fine non sopravviverà .Nel caso di massa residua visibile e marcatori normalizzati ,è indicata la resezione chirurgica .In pazienti con lesioni <1 cm , vi è ancora un aumentato rischio di cancro o teratoma residuo anche se il ruolo della chirurgia in questa impostazione è dibattuto . In caso di persistente malattia a livello retroperitoneale , tutte le aree in cui ci sono siti metastatici devono essere completamente asportati entro 4-6 settimane dal completamento della chemioterapia . Se tecnicamente possibile, una procedura nerve-sparing deve essere eseguita.Complessivamente , a seguito di chemioterapia PEB di induzione , solo il 10 % delle masse residue contiene malattia attiva , 50%contiene teratoma maturo , e il 40 % contiene tessuto necrotico - fibrotico . Finora , nessuna indagine di imaging , tra cui PET ,o un modello di prognosi , sono in grado di prevedere la differenziazione istologica del residuo non seminomatoso del tumore . Così , la resezione del tumore residuo è obbligatorio in tutti i pazienti con malattia residua > 1 cm .L' estensione della chirurgia dovrebbe essere basata sul rischio di recidiva di un singolo paziente e alla qualità della vita. Se possibile , tutte le masse devono essere asportate, perché una resezione completa , nel contesto di cellule maligne vitali,è più critica di quanto il ricorso alla chemioterapia post-operatoria. C'è una crescente evidenza che resezioni " modello" in pazienti selezionati ottengano risultati equivalenti a lungo termine rispetto alle resezioni sistematiche bilaterali in tutti i pazienti . Tuttavia, la semplice resezione del tumore residuo non deve essere eseguita .
7.3.3 Qualità della chirurgia
La chirurgia post - chemioterapia è esigente e richiede interventi ad hoc vascolari ( come la vena cava frequentemente o protesi aortica ) . Pertanto, i pazienti dovrebbero essere indirizzati a centri specializzati in grado di proporre chirurgia interdisciplinare( resezioni epatiche , neurochirurgia spinale , chirurgia toracica ) . I pazienti trattati all'interno di tali centri beneficiano di una significativa riduzione della mortalità perioperatoria dal 6% al 0,8 % .Inoltre , i chirurghi urologici specializzati sono in grado di ridurre il tasso di recidiva locale dal 16% al 3 % con un più alto tasso di resezioni complete .
7.3.4 Consolidamento chemioterapia dopo l'intervento chirurgico secondario
Dopo la resezione di necrosi o teratoma maturo/ immaturo , non è necessario alcun ulteriore trattamento . Nel caso di resezione incompleta di altre patologie tumorali delle cellule germinali , due cicli adiuvanti di chemioterapia a base di cisplatino può essere somministrato in alcuni sottogruppi (ad esempio, dei pazienti prognosi infausta » ) .Dopo resezione completa del tumore ' vitale ' <10 % del volume totale ,specialmente nei pazienti con un primo buon gruppo prognosi secondo IGCCCG , il tasso di recidiva è molto basso e la chemioterapia adiuvante non è vantaggiosa per evitare ulteriori ricadute. La prognosi sarà sicuramente peggiore se la neoplasia maligna vitale è trovata nei campioni di resezione dopo la chemioterapia di seconda e terza line. In quest'ultima situazione , la chemioterapia post-operatoria non è indicata e non è in grado di migliorare la prognosi.
7.4 trattamento di salvataggio sistemico per ricaduta o malattia refrattaria
La chemioterapia di salvataggio a base di cisplatino comporterà remissioni a lungo termine per circa il 50 % dei pazienti che ricadono dopo chemioterapia di prima linea . I regimi di scelta sono quattro cicli di PEI / VIP( etoposide , ifosfamide , cisplatino ) , quattro cicli di TIP ( paclitaxel , ifosfamide , cisplatino) o quattro cicli di VeIP( vinblastina , ifosfamide , cisplatino ) .Uno studio randomizzato ha mostrato nessun beneficio nella sopravvivenza libera da progressione né la sopravvivenza globale nei pazienti trattati con 3 cicli di VeIP più 1 ciclo di chemioterapia ad alte dosi , rispetto ai 4 cicli di VeIP . Attualmente, è impossibile determinare se la combinazione di chemioterapia a base di platino è sufficiente come trattamento di prima di salvataggio o se l'intensificazione precoce del trattamento prima di salvataggio con alte dosi di chemioterapia dovrebbe essere tentata .Convenzionalmente la chemioterapia di salvataggio può ottenere remissioni a lungo termine nel 15-40% dei pazienti, a seconda di fattori di rischio individuali. Il IGCCCG-2 score prognostico è composto da 7 fattori importanti come elencato nella tabella 10 (istologia seminoma vs non-seminoma , sede del tumore primario, la risposta alla chemioterapia iniziale, la durata dell’intervallo progressionfree , AFP livello marker di salvataggio, livello marcatore HCG a recupero, e la presenza di metastasi a fegato, osso, o cervello). Utilizzando questi fattori, 5 gruppi a rischio (molto basso rischio = -1 punti; basso rischio = 0 punti; a rischio intermedio = 1-2 punti, ad alto rischio = 3-4 punti; e rischio molto elevato> 5 punti) sono stati identificati con differenze significative nella PFS e OS. La terapia di salvataggio con VeIP non è probabilmente superiore a altra combinazione a base di cisplatino ai regimi convenzionalmente dosati. Recentemente , paclitaxel e gemcitabina hanno dimostrato di essere attivi nel trattamento di tumori delle cellule germinali refrattari ; entrambi i farmaci sono sinergici con cisplatino.A seconda della presenza di fattori prognostici negativi , i risultati del recupero dopo terapia di prima linea con trattamento a base di cisplatino sono insoddisfacenti . Anche se alcuni studi di fase II indicano un 10% di miglioramento della sopravvivenza con l'intensificazione precoce del trattamento di prima linea di salvataggio con chemioterapia ad alte dosi ,altri non riescono a dimostrare tale miglioramento .
7.4.1 La recidiva tardiva ( > 2 anni dopo la fine del trattamento di prima linea )
Il paziente recidivante tardivamente è definito come qualsiasi paziente recidivante più di due anni dopo la chemioterapia per metastasi da non seminoma . Se tecnicamente possibile , tutti i pazienti non- seminoma con recidiva tardiva dovrebbero essere sottoposti a immediatamente a chirurgia radicale di tutte le lesioni , indipendentemente dal livello dei loro marcatori tumorali bisogna asportare completamente tutti i tumori indifferenziato a cellule germinali , teratoma maturo o carcinoma a cellule non germinali secondario.I pazienti con rapido aumento di HCG possono rappresentare un'eccezione per un intervento chirurgico immediato e possono beneficiare di induzione di chemioterapia prima della resezione completa . Se le lesioni non sono completamente resecabili , dovrebbero essere effettuate delle biopsie per la valutazione istologica e la chemioterapia di salvataggio deve essere iniziato secondo i risultati istologici . In questi casi è necessaria la consultazione di un patologo esperto per evitare errata interpretazione dei cambiamenti morfologici terapeutici nelle neoplasie delle cellule germinali . Se il paziente risponde alla chemioterapia , la chirurgia secondaria deve essere effettuata ogni qualvolta possibile. Nel caso di malattia refrattaria resecabile , ma localizzato , la radioterapia può essere considerata. Per evitare eccesso di mortalità,le ricadute devono essere trattate in centri con esperienza nella gestione di questi pazienti .
7.5 La chirurgia di salvataggio
I tumori residui dopo chemioterapia di salvataggio devono essere asportati , se possibile. Nel caso di progressione del marcatore dopo il trattamento di salvataggio e la mancanza di altre opzioni chemioterapiche, la resezione dei tumori residui deve essere considerato se la resezione completa di tutto il tumore sembra possibile ( circa il 25 % sopravvivenza a lungo termine può essere conseguito ) .
7.6 Il trattamento delle metastasi cerebrali
Le metastasi cerebrali si verificano nell'ambito di una ricaduta sistemica e raramente come ricaduta isolata . La sopravvivenza a lungo termine dei pazienti con metastasi cerebrali alla diagnosi iniziale è scarsa ( 30-40 % ) , ma anche scarso è lo sviluppo di una metastasi cerebrale come una malattia ricorrente ( la sopravvivenza a 5 anni ha un tasso del 2-5% ). La chemioterapia è il trattamento iniziale in questo caso , e alcuni dati supportano l'utilizzo di radioterapia di consolidamento, anche nel caso di una risposta totale dopo la chemioterapia . La chirurgia può essere considerato nel caso di una metastasi solitaria persistente , a seconda dell’ istologia del tumore primario e la posizione delle metastasi.
8 . Follow-up dopo terapia curativa
8.1 Considerazioni generali
La selezione del test da eseguire in follow - up deve rispettare i seguenti principi :
• l'intervallo fra l'esame e la durata della prova deve essere coerente con il tempo di rischio massimo di recidiva e la storia naturale del tumore ;
• le prove dovrebbero essere rivolta ai più probabili siti di recidiva e dovrebbero avere un elevato valore predittivo , sia positivo che negativo ;
• la terapia deve portare ad prolungamento significativo della vita o palliazione dei sintomi . L' inizio della terapia precedente dovrebbe migliorare i risultati rispetto alla terapia data quando il paziente diventa sintomatico della recidiva del tumore ;
• l'aumento del rischio di tumore secondario , sia nel sito primario e in altri tessuti che possono essere stati esposti alle stesse sostanze cancerogene , o in cui vi è evidenza epidemiologica di maggiorerischio , dovrebbe anche guidare l'ordinamento delle prove . Complicanze maligne e non maligne della terapia devono inoltre essere considerate . Tale test deve essere eseguito con una frequenza e durata coerente con la natura del rischio , e comprende test solo con alto valore predittivo positivo e negativo .
Le seguenti considerazioni si applicano in modo generale per la selezione di un programma e di prova appropriato nel follow - up di tutte le fasi del tumore del testicolo .
• La maggior parte delle recidive dopo la terapia curativa si verificherà nei primi 2 anni; la vigilanza dovrebbe essere più frequente ed intensa in questo periodo .
• recidive tardive possono verificarsi oltre i 5 anni , e quindi ogni anno di follow- up per la vita può essere sostenuto .
• Dopo RPLND ,la ricaduta nel retroperitoneo è rara , il sito più significativo di recidiva è il torace .
• Il valore di una radiografia del torace normale è stato recentemente messo in discussione nel follow- up di pazienti con malattia disseminata dopo la remissione completa .
• TC del torace ha un valore predittivo superiore rispetto alla semplice radiografia del torace .
• I risultati della terapia dipendono dalla massa di malattia ; quindi una strategia intensiva per rilevare la malattia asintomatica può essere giustificabile .
• Dopo la chemioterapia o la radioterapia , vi è il rischio a lungo termine dello sviluppo di neoplasie secondarie .
• L'esposizione ai raggi X diagnostici provoca tumori secondari . Così , la frequenza delle TC dovrebbe essere generalmente ridotta e qualsiasi esposizione ai raggi X deve essere ben giustificato in una coorte di pazienti con una lunga aspettativa di vita dopo il successo del trattamento.
• In centri specializzati ,la TC può essere sostituito da MRI . Tuttavia , la MRI è un metodo in base al protocollo e , quindi , deve essere eseguita nello stesso ente con un protocollo standardizzato .
• Con particolare competenza , gli ultrasuoni possono essere utilizzati come un metodo per lo screening del retroperitoneo durante il follow - up .Tuttavia , il metodo è molto operatore-dipendente e non può essere raccomandato come metodo generale durante il follow- up .
•un più lungo follow - up nei pazienti dopo radioterapia e la chemioterapia è giustificato per rilevare le tossicità tardive( ad esempio cardio - vascolare , endocrino ) .
Un certo numero di organizzazioni interdisciplinari hanno presentato le raccomandazioni per il follow- up del cancro ai testicoli. Le tabelle di follow -up presentate di seguito presentano i criteri minimi di follow –up e dovrebbero quindi essere considerati come un livello di evidenza A.
8.2 Follow-up : non- seminoma stadio I
Circa il 5 % dei pazienti con CS1 NSGCT presentano livelli elevati di marcatori tumorali dopo orchiectomia , e fino al 25-30 % ricaduta durante i primi 2 anni.Il programma di follow - up varia a seconda di quale delle tre possibili strategie di trattamento è stato scelta :
• sorveglianza ;
• nerve-sparing RPLND ;
• chemioterapia adiuvante .
8.2.1 indagini di follow - up durante la sorveglianza
I risultati di una politica di sorveglianza dipendono da una attenta procedura di stadiazione pre-operatoria e gestione del follow -up . In una politica di ' wait and see ' , le recidive si verificano nel 30 % dei casi . Di queste ricadute ,l’80% si verificherà nei primi 12 mesi dopo orchiectomia , e circa il 12 % durante il secondo anno . Il tempo medio per la ricaduta è di 6 mesi (range 1-62 mesi ) , ma le recidive dopo 3-5 anni , e anche più tardi ,possono ancora verificarsi , con un tasso annuo del 4 %. La ricaduta avviene prevalentemente nel retroperitoneo : circa il 70 % dei pazienti hanno metastasi evidenti nel retroperitoneo , e 10 % nel mediastino e polmoni . A volte l'unica indicazione è un elevato livello di markers tumorali .Uno studio randomizzato di due contro cinque TA è stato pubblicato da MRCe ha raccomandando la riduzione delle immagini durante la vigilanza in questa fase, ad una TC a 3 mesi dopo orchiectomia , e un’altra a 12 mesi.
Tabella : programma di follow-up consigliato in una politica di sorveglianza: non-seminoma stadio I
procedura Anno
1 2 3-5 6-10
L'esame fisico 4 volte 4 volte Una volta / anno una volta / anno
Marcatori tumorali 4 volte 4 volte Una volta / anno una volta / anno
radiografia del torace 2 volte 2 volte
TC Addome-pelvi due volte (a 3 e 12 mesi)
8.2.2 Follow- up dopo nerve-sparing RPLND
La recidiva retroperitoneale dopo RPLND nerve-sparing eseguito correttamente è rara . RPLND dovrebbe eliminare i linfonodi retroperitoneali come sito di recidiva e quindi la necessità di TA addominali ripetuti.I dati dello studio Cancer Intergroup mostrano recidiva retroperitoneale in 7/ 264 pazienti con malattia in stadio patologico I ( e 20 recidive polmonari ) ; quattro di questi sette non avevano aumento del marcatore. Nella serie Indiana , una sola ricaduta in 559 casi è stato segnalata . In caso di recidiva , è generalmente nel torace , collo o ai margini del campo chirurgico .Recidive polmonari si verificano nel 10-12% dei pazienti , e > 90 % di tali recidive si verificano entro 2 anni RPLND. Tuttavia, il basso tasso di recidiva retroperitoneale dopo RPLND può essere raggiunto solo da un intervento chirurgico in centri specializzati , come mostrato dal tasso elevato nel campo recidiva ( 7/13 recidive ) nello studio randomizzato TedescoRPLND contro un ciclo di PEB . Il programma di follow - up minimo raccomandato è mostrato nella Tabella seguente.
Tabella : programma di follow - up positiva dopo linfoadenectomia retroperitoneale o chemioterapia adiuvante di un non-seminoma di stadio I
Procedura Anno
1 2 3-5 6-10
L'esame fisico 4 volte 4 volte Una volta / anno una volta / anno
Tumore marcatori 4 volte 4 volte Una volta / anno una volta / anno
radiografia del torace 2 volte 2 volte
TC addome-pelvi 1 volta 1 volta
8.2.3 Follow- up dopo la chemioterapia adiuvante
I futuri rapporti con follow –up a lungo termine dopo chemioterapia adiuvante hanno dimostrato un basso tasso di recidive di circa il 3 % . In uno studio randomizzato , con un corso di PEB contro RPLND , il tasso di recidiva con la chemioterapia adiuvante è stato 1 % (2/ 174 pazienti) . La necessità di ripetere la valutazione a lungo termine del retroperitoneo non è ancora chiara .
8.3 Follow-up : stadio I seminoma
La maggior parte dei pazienti con seminoma ( 70-80 % ) presentano con malattia allo stadio clinico I al momento della diagnosi . Nel 15-20 % dei casi , non vi è coinvolgimento linfonodale radiologico a livello del retroperitoneo , e solo il 5 % dei pazienti si presenta con metastasi a distanza .Le gamme dei tassi di recidiva è dell’ 1-20 % , a seconda della terapia post- orchiectomia scelta . Solo fino al 30% dei seminomi presentano elevazione di hCG al momento della diagnosi o nel corso della malattia . Di conseguenza , nella maggior parte dei casi , la misurazione dei marcatori nel sangue non sarà un test affidabile per il follow - up . Le opzioni di trattamento post-orchidectomia in seminoma stadio I seminoma sono la radioterapia retroperitoneale , la sorveglianza e la chemioterapia adiuvante .Grazie alla estrema radio e chemiosensibilità , alti tassi di guarigione di quasi il 100 % vengono raggiunti con ciascuno degli approcci , anche nei casi di recidiva . I costi delle diverse terapie variano, come variano gli effetti collaterali attesi.
8.3.1 Follow- up dopo la radioterapia
Basse dosi di radioterapia ( 20-24 Gy) limitate al campo retroperitoneale o al campo da hockey -stick raggiungono un generale tasso di sopravvivenza di circa il 99 % a 5-10 anni . Il tasso di recidiva è del 1-2% e la maggior parte del tempo comune di presentazione è entro 18 mesi di trattamento , anche se in ritardo recidive sono state descritte . Il sito di recidiva è principalmente ai linfonodi sopradiaframmatici ,mediastino , polmoni o le ossa . In una piccola percentuale di casi , la ricaduta del tumore avviene nei linfonodi inguinale o iliaci esterni.Gli effetti collaterali della radioterapia includono alterazione temporanea della spermatogenesi , sintomi gastrointestinali ( ulcera peptica ) , e induzione di tumori secondari. Fino al 50% dei pazienti può sviluppare tossicità moderata di grado I-II. Il programma di follow-up è descritto nella Tabella seguente.
Tabella: programma di follow-up Consigliato per la sorveglianza post-orchiectomia, radioterapia o
chemioterapia: stadio I seminoma
procedura Anno
1 2 3-4 5-10
L'esame fisico 3 volte 3 volte una volta / anno una volta / anno
Marcatori tumorali 3 volte 3 volte una volta / anno una volta / anno
radiografia del torace 2 volte 2 volte
TC addome-pelvi 2 volte 2 volte
8.3.2 Follow- up durante la sorveglianza
Il rischio attuariale di recidiva a 5 anni varia tra il 6 % ( a basso rischio) e 20 % . Non c'è aumento del rischio di morte . Il tempo medio alla ricaduta è a intervalli di 12-18 mesi , ma fino al 29 % di recidive possono svilupparsi dopo tale periodo. I siti di ricaduta sono i linfonodi PA fino al 82 % dei casi ; linfonodi pelvici, linfonodi inguinali e polmoni possono essere colpiti. A causa dell’elevato e spesso in ritardo tasso di recidiva , è obbligatoria uno stretto follow-up per almeno 5 anni.
8.3.3 Follow- up dopo la chemioterapia adiuvante
Uno o due cicli di chemioterapia a base di carboplatino rappresentano un trattamento alternativo efficace nel seminoma di grado I . Il tasso di recidiva è 1,9-4,5 % . In generale , questo trattamento è ben tollerato , con solo tossicità a medio termine lieve , acuta. I dati a lungo termine sulla recidive tardive e la sopravvivenza sono mancanti.
8.4 Follow-up : fase II e fase avanzata della malattia ( metastatica )
Più avanzata è la malattia a livello linfonodale, maggiore è la probabilità di recidiva. In generale ,la massa tumorale primaria governa il risultato per i pazienti con NSGCT . Nella fase II NSGCT , indipendentemente dalla politica di trattamento adottata , sono raggiunti ottimi tassi di sopravvivenza del 97% a condizione che la ricaduta sia precocemente riconosciuta .In tumori germinali metastatici avanzati , l' estensione della malattia correla con la risposta alla terapia e con la sopravvivenza . La combinazione di chemioterapia a base di cisplatino e chirurgia ( multimodalità aggressivo) raggiunge percentuali di guarigione tra il 65-85 % , a seconda del grado iniziale della malattia. Le principali ragioni del fallimento della terapia in NSGCT avanzato sono :
• la presenza della malattia ingombrante che non risponde completamente alla chemioterapia ;
• teratoma residuo resecabile dopo la chemioterapia ;
• la presenza o lo sviluppo di elementi non germinali chemioresistenti , che rappresentano l’8,2% del
casi .
Tabella : programma di follow-up minimo consigliato advanced NSGCT e seminoma
procedura Anno
1 2 3-5 Successivamente
L'esame fisico 4 volte 4 volte due volte / anno una volta / anno
Tumore marcatori 4 volte 4 volte due volte / anno una volta / anno
Radiografia del torace 4 volte 4 volte due volte / anno una volta / anno
TC addome-pelvi Twice Twice As indicato come indicato
TC del torace come indicato come indicato come indicato come indicato
TC cervello Come indicato come indicato come indicato come indicato
Un CT addominale deve essere eseguita almeno una volta all'anno, se il teratoma si trova nel retroperitoneo.
† Se la valutazione post-chemioterapia in un paziente con seminoma mostra qualche massa> 3 centimetri, sarebbe appropriato ripeterla dopo 2 e 4 mesi dopo per assicurare che la massa continua a regredire. Se disponibile, può essere effettuata FDG-PET/CT .
‡ Una TC del torace è indicata se viene rilevata un'anomalia su una radiografia del torace normale e dopo resezione polmonare.
§ Nei pazienti con mal di testa, problemi neurologici focali, o tutti i sintomi del sistema nervoso centrale.
9 . TUMORI STROMALI DEL TESTICOLO
9.1 Background
I tumori stromali del testicolo sono rari e rappresentano solo il 2-4 % dei tumori testicolari adulti. Tuttavia, solo i tumori delle cellule del Leydig e a cellule di Sertoli sono di rilevanza clinica . Poiché non sono stati pubblicati raccomandazioni generali , il gruppo di lavoro del EAU sul cancro testicolare ha deciso di includere questi tumori in Germ EAU orientamenti. Raccomandazioni per la diagnosi e il trattamento sono riportati solo per i tumori delle cellule del Leydig e del Sertoli.
9.2 Metodi
E’ stata eseguita una ricerca su Medline per i tumori delle cellule di Leydig ( sinonimo : tumore a cellule interstiziali ) e tumori delle cellule di Sertoli ( sinonimo :androblastoma ). Sono stati trovati circa 850 casi. Dopo aver escluso i dati di laboratorio, i tumori femminili e pediatrici e casi di animali ,sono rimasti 371 casi documentati . La reale incidenza di tumori stromali rimane quindi incerta.Tuttavia , i sintomi di sospetto pre -operatorio dei tumori stromali testicolari e le caratteristiche dei tumori ad alto rischio per le metastasi sono sufficientemente ben stabilite ( LE : 2a/2b ) per consentire raccomandazioni riguardo la diagnosi e l’approccio chirurgico . Tuttavia, non ci sono raccomandazioni per un adeguato follow -up a causa della mancanza di dati di follow- up nei casi più segnalati , né ci sono informazioni circa l'esito fatale metastatico dei tumori , indipendentemente dalla terapia scelta .
9.3 Classificazione
I tumori a cellule non germinali del testicolo includono i tumori stromali gonadici e vari tumori stromali non- specifici. I diversi sottotipi istologici di tumori testicolari sono definite secondo la classificazione WHO 2004.
9.4 tumori delle cellule di Leydig
9.4.1 Epidemiologia
I tumori delle cellule di Leydig costituiscono ~ 1-3 % dei tumori testicolari adulti ( 2,8 ) e il 3 % dei tumori testicolari nei neonati e bambini. Il tumore è più comune nella terza-sesta decade negli adulti , con un’incidenza simile osservato in ogni decennio . Un altro picco di incidenza è visto nei bambini di età compresa tra 3 e 9 anni.Solo il 3 % dei tumori delle cellule di Leydig sono bilaterali. Di tanto in tanto , si verificano in pazienti con sindrome di Klinefelter .
9.4.2 Anatomia patologica dei tumori a cellule di Leydig
I tumori a cellule di Leydig sono il tipo più comune di tumori stromali gonadici .A livello istopatologico sono ben delineati e di solito fino a 5 cm di diametro . Sono anche solidi , di colore giallo a marrone chiaro , con emorragia e / o necrosi presente nel 30 % dei casi . Microscopicamente , le cellule sono poligonali , concitoplasma eosinofilo con cristalli occasionali di Reinke , nucleo regolare , la disposizione solida e stroma capillare . Le cellule esprimono vimentina , inibina , proteina S -100 , ormoni steroidei , calretinina e citocheratina ( focale ) .
Circa il 10 % dei tumori delle cellule di Leydig sono tumori maligni , che presentano i seguenti parametri :
• grandi dimensioni (> 5 cm) ;
•atipie citologiche ;
• aumento dell'attività mitotica ( > 3 per 10 di campo ad alta potenza [ HPF ] ) ;
• aumento del MIB -1 ( 18,6 % vs 1,2 % nel benigno) ;
• necrosi ;
• invasione vascolare ;
• margini infiltranti ;
• l'estensione oltre il parenchima testicolare ;
• aneuploidia del DNA .
9.4.3 Diagnosi
I pazienti presentano una dolenza allargata al testicolo o il tumore è un scoperto accidentalmente con ultrasuoni. Fino all’80 % dei casi sono riportati disturbi ormonali con estrogeni ad alto livello e livelli di estradiolo e testosterone basso , aumento dei livelli di LH e FSH , mentre i risultati negativi sono sempre ottenuti per i markers dwi tumori delle cellule germinali testicolari come AFP , hCG , LDH e PLAP . Circa il 30 % dei pazienti presenta ginecomastia .Solo il 3 % dei tumori sono bilaterali .I tumori delle cellule del Leydig devono essere distinti dalla malattia multinodulare simil-tumorale e spesso bilateralmente si verificano lesioni della sindrome androgenitale . Il Work-up diagnostico deve comprendere marcatori , ormoni (almeno testosterone , LH e FSH , inoltre estrogeni , estradiolo , progesterone e cortisolo ) ,ecografia di entrambi i testicoli , e TC di torace e addome . All’ecografia, potrebbe essere possibile osservare piccole lesioni ipoecogene ben definite con ipervascolarizzazione, ma l'aspetto è variabile ed è indistinguibile dai tumori germinali.La proporzione dei tumori metastatici in tutte le case report pubblicati è solo del 10 %.Con più lungo follow- up , 18 tumori metastatici sono stati trovati in un totale di 83 casi ( 21,7 % ) .Segni istopatologici di malignità sono state rappresentati in precedenza (cfr. 4.2) . Inoltre, i pazienti di età avanzata hanno un rischio maggiore di avere un tumore di potenziale maligno .
9.4.4 Trattamento
I tumori testicolari asintomatici di piccolo volume vengono spesso erroneamente interpretati come tumori a cellule germinali , e viene eseguita orchiectomia inguinale . Si consiglia vivamente di eseguire una procedura di organo sparing in ogni piccola lesione intraparenchimale al fine di avere la diagnosi istologica . Specialmente nei pazienti con sintomi di ginecomastia o disturbi ormonali , un tumore non a cellule germinali deve essere considerato e immediatamente bisogna evitare l’orchiectomia . In caso di tumore a cellule germinali in entrambe le sezioni congelate ( tessuto fresco ) o paraffina ,l’orchiectomia è raccomandata finché un testicolo normale controlaterale è presente.Nei tumori stromali con segni istologici di malignità , specialmente in pazienti di età più avanzata , sono consigliati orchiectomia e linfoadenectomia retroperitoneale per prevenire le metastasi . Senza segni istologici di malignità ,è consigliabile una strategia di sorveglianza individuale edopo è consigliabile orchiectomia (TC follow - up può essere più adeguato in quanto marcatori tumorali specifici non sono disponibili ) .I tumori che hanno dato metastasi ai linfonodi , polmone, fegato o midollo rispondono poco alla chemioterapia o alla radiazione e la sopravvivenza è scarsa.
9.4.5 Follow- up
Le raccomandazioni per un adeguato follow -up non possono essere date a causa della mancanza di dati di follow- up.
9.5 tumore a cellule di Sertoli
9.5.1 Epidemiologia
I tumori delle cellule di Sertoli rappresentano <1% dei tumori testicolari, e l'età media alla diagnosi è di circa 45 anni, con rari casi sotto i 20 anni di età . In rare occasioni, questi tumori possono svilupparsi nei pazienti con sindrome di insensibilità agli androgeni enella sindrome di Peutz-Jeghers.
9.5.2 Anatomia patologica dei tumori delle cellule di Sertoli
Il tumore è ben circoscritto , giallo, marrone chiaro o bianco , con un diametro medio di 3,5 centimetri.Microscopicamente , le cellule sono eosinofile,pallide con citoplasma vacuolato . I nuclei sono regolari con scanalature e ci possono essere inclusioni . La disposizione delle cellule è tubulare o solida.Lo stroma è fine e capillare , ma in alcuni casi un aspetto sclerosante predomina . Le cellule esprimono vimentina ,citocheratine , inibina ( 40 % ) e la proteina S - 100 ( 30 % ).Il tasso di tumori maligni varia 10-22 % e sono stati segnalati <50 casi. Segni di un tumore maligno di Sertoli sono :
• grandi dimensioni (> 5 cm) ;
• nuclei pleomorfi con nucleoli ;
• aumento dell'attività mitotica ( > 5 per 10 HPF ) ;
• necrosi ;
• invasione vascolare .
9.5.2.1 Classificazione
Tre sottotipi sono stati descritti :
• il tumore classico cellule di Sertoli ;
• la grande forma calcificata delle cellule con calcificazioni caratteristiche ;
• la forma sclerosante rara .
9.5.3 Diagnosi
I pazienti presentano un aumentato volume testicolare o il tumore è un reperto accidentale all’ecografia. La maggior parte del tumore a cellule di Sertoli classico è unilaterali e unifocale . Disturbi ormonali sono frequenti , anche se a volte è valutabile ginecomastia .I marcatori tumorali AFP , hCG , LDH e PLAP sono sempre negativi . Il work-up diagnostico deve comprendere marcatori tumorali , ormoni (almeno testosterone, LH e FSH , inoltre estrogeni , estradiolo , progesterone e cortisolo ) ,ecografia di entrambi i testicoli e TC del torace e l'addome .I tumori delle cellule di Sertoli sono generalmente ipoecogeni all’ecografia , ma possono essere di aspetto variabile e pertanto non possono essere distinte in modo sicuro da tumori germinali . Solo la forma calcificata a grandi cellule ha una caratteristica immagine di fuochi ecogeni vivaci a causa di calcificazione.La forma calcificata a grandi cellule è diagnosticata in uomini più giovani ed è associata a sindromi genetiche ( la sindrome di Peutz - Jeghers ) o , in ~ 40% dei casi , disturbi endocrini . Un totale di 44 % di casi sono bilaterali , sia sincroni o metacroni , e il 28 % mostra multifocalità . Tuttavia , tra i pazienti il cui i tumori sono stati istopatologicamente classificati come ' maligni ' con queste o simili caratteristiche (ad esempio 18,8 % dei tumori in tutti i casi segnalati ) , solo il 7 % ha mostrato malattia metastatica durante il follow - up .Fino al 20 % della forma sclerosante a grandi cellule sono maligni . Ci sono alcuni indizi che la discriminazione tra un tipo precoce e uno a tardiva insorgenza può definire un rischio diverso per la malattia metastatica ( 5,5 vs 23%) .Metastasi nel sottotipo sclerosante sono rari .
9.5.4 Trattamento
Tumori testicolari di piccolo volume , altrimenti asintomatici , sono spesso erroneamente interpretati come tumori a cellule germinali e viene eseguita orchiectomia inguinale . Si consiglia vivamente di procedere con un approccio organo- sparing in piccole lesioni testicolari intraparenchimali fino all’esame istologico finale.La chirurgia organo-sparing dovrebbe essere considerata specialmente nei pazienti con sintomi di ginecomastia o disturbi ormonali o tipica imaging su all’ecografia ( calcificazioni , piccoli tumori circoscritti ) . L’orchiectomia secondaria può essere eseguita se la patologia finale rivela un tumore non- stromale (ad esempio a cellule germinali ). Approcci chirurgici organo- sparing sono giustificati finché il restante parenchima testicolare è sufficiente per funzione endocrina ( e nei tumori stromali anche esocrina ).Nei tumori con segni istologici di malignità , specialmente in pazienti di età più avanzata , orchiectomia elinfoadenectomia retroperitoneale sono raccomandati per prevenire le metastasi . Senza segni di malignità,una strategia di sorveglianza individuale dopo orchiectomia è raccomandata ( CT può essere più adeguato in quanto specifici marcatori tumorali non sono disponibili) . Tumori metastatici ai linfonodi , polmone o osso rispondono male a chemioterapia o radiazioni , e la sopravvivenza è bassa .
9.5.5 Follow- up
Raccomandazioni per un adeguato follow -up non possono essere date a causa della mancanza di dati di follow- up.
9.6 tumore a cellule della granulosa
Questo è un tumore raro , con due varianti : giovani e adulti .
• Il tipo giovanile è benigno . È il tumore testicolo congenito più frequente e rappresenta il 6,6% del
tutte le neoplasie del testicolo prepuberale . L'aspetto cistico è caratteristico di questo tipo di tumore .
• Con il tipo adulto , l'età media alla presentazione è di 44 anni. La morfologia tipica è di una neoplasia omogenea, tumore giallo-grigio , con cellule allungate con scanalature in microtrapianto e corpi di Call- Exner.
I tumori maligni rappresentano ~ 20% dei casi . Essi sono di solito > 7 cm di diametro . Invasione vascolare e necrosi sono caratteristiche suggestive di biologia maligna .
9.7 gruppo tecoma / fibroma dei tumori
Questi tumori sono molto rari e benigni .
9.8 tumori stromali gonadici
I tumori stromali gonadici e midollari possono essere forme non completamente differenziate o misti .
C'è una esperienza limitata con neoplasie non completamente differenziate / tumori stromali gonadici e nessun caso di metastasi segnalata. Nelle forme tumorali miste , devono essere riportati tutti i componenti istologici . Tuttavia ,il comportamento clinico è il più importante per riflettere il modello predominante o la componente più aggressiva del tumore .
9.9 Tumori contenenti cellule germinali e del cordone sessuale / stroma gonadico ( gonadoblastoma )
Se la disposizione delle cellule germinali sono in un modello nidificata e il resto del tumore è composto di stroma gonadico , viene usato il termine gonadoblastoma . E ' più frequente in disgenesia gonadica con ambiguità dei genitali . I tumori bilaterali sono presenti nel 40% dei casi . La prognosi si correla con la crescita invasiva della componente germinale .Nel caso di una disposizione diffusa dei diversi componenti , ci sono alcuni dubbi sulla natura neoplastica delle cellule germinali e alcuni autori ritengono che le cellule stesse siano intrappolate anziché essere neoplastiche.
9.10 tumori diversi di testicolo
9.10.1 Tumori di tipo epiteliale ovarico
Questi tumori somigliano ai tumori epiteliali dell'ovaio.Può essere osservato un aspetto cistico con materiale mucinoso occasionale. Microscopicamente, l'aspetto è identico alle loro controparti ovariche, e la loro evoluzione è simile a quella dei diversi sottotipi ovarici epiteliali. Alcuni tipi Brenner possono essere maligni.
9.10.2 Tumori dei collettori e rete testis
Questi tumori sono molto rari.Sono stati segnalati tumori benigni (adenoma) e maligni (adenocarcinoma), con tumori maligni che mostrano la crescita locale con una mortalità del 56%.
9.10.3 tumori (benigni e maligni) di stroma non specifico
Questi sono molto rari e hanno criteri simili ai sarcomi dei tessuti molli,lo stesso dicasi per prognosi e trattamento.
Traduzione dalle linee guida EAU a cura del Dott. Marzio Vittorio e Dott. Igino Intermite